
Leest u dit met een smartphone?
Met (enkele) smartphones moet u zelf uitmaken welke modus voor u geschikt is

Leest u dit met een smartphone?
Met (enkele) smartphones moet u zelf uitmaken welke modus voor u geschikt is
[Een controlelezing door iemand met een natuurwetenschappelijke achtergrond is welkom! Info & Contact]
Net als warmte, maar op een andere manier, is elektriciteit overal. Er is bijna geen verandering op Aarde, zonder dat er elektrische fenomenen worden gedetecteerd. Water dat verdampt, een vlam, als twee verschillende of verschillend verhitte metalen of ijzer- en koper(II)sulfaatoplossing elkaar raken, enz., vinden er naast de meer voor de hand liggende fysische of chemische verschijnselen ook elektrische processen plaats. Hoe nauwkeuriger we de meest uiteenlopende natuurlijke processen onderzoeken, hoe meer we sporen van elektriciteit tegenkomen. Ondanks de alomtegenwoordigheid ervan, ondanks het feit dat elektriciteit sinds een halve eeuw steeds meer industrieel de mens dienstig is, is het de vorm van de beweging en de aard ervan, waarover nog steeds de grootste duisternis heerst. De ontdekking van de galvanische stroom is ongeveer 25 jaar jonger dan die van zuurstof en betekent minstens zoveel voor de studie van elektriciteit als voor de chemie. En toch, wat een verschil vandaag de dag op beide gebieden! In de chemie [cursief van de vertaler], met name dankzij Daltons ontdekking van atoomgewichten, orde, relatieve zekerheid over wat er bereikt is, en een systematische, bijna geplande aanval op het nog niet veroverde gebied, vergelijkbaar met de ordelijke belegering van een fort. In de elektriciteitsleer [cursief van de vertaler], een desolate ballast van oude, onzekere, noch definitief bevestigde, noch definitief verworpen experimenten; een onzeker rondtasten in het donker, een onsamenhangend onderzoek en experimenteren door vele individuen, die het onbekende terrein fragmentair aanvallen, als een nomadische zwerm ruiters. Maar natuurlijk moet een ontdekking als die van Dalton – een brandpunt voor alle wetenschap en een stevige basis voor onderzoek – nog steeds worden verricht op het gebied van elektriciteit. Het is in wezen deze toestand van de elektriciteitstheorie, die het vooralsnog onmogelijk maakt om een allesomvattende theorie te hebben en het eenzijdige empirisme op dit gebied doet zegevieren, een empirisme dat zichzelf verbiedt om te denken, en dat dus niet alleen verkeerd denkt, maar ook niet in staat is om de feiten getrouw te volgen of te rapporteren, en dat dus het tegenovergestelde wordt van het echte empirisme.
Als het doorgaans goed is om deze natuurwetenschappers (die niets lelijks kunnen zeggen over de a-prioristische speculaties van de Duitse natuurfilosofie), om die aan te bevelen, niet alleen de theoretische werken, maar zelfs de latere natuur-theoretische werken van de empirische school te lezen, dan geldt dit vooral voor de elektriciteitstheorie. Laten we een artikel nemen uit het jaar 1840: An Outline of the Sciences of Heat and Electricity van Thomas Thomson. De oude Thomson was een autoriteit in zijn tijd; hij had ook een zeer belangrijk deel van het werk van Faraday, de grootste specialist in elektriciteit tot nu toe, tot zijn beschikking. En toch bevat zijn boek minstens evenveel absurde zaken als het corresponderende deel van de veel oudere hegeliaanse natuurfilosofie. De beschrijving van de elektrische vonk zou bijvoorbeeld rechtstreeks kunnen worden vertaald uit de overeenkomstige passage van Hegel. Beide geven een opsomming van alle wonderlijke dingen die men erin wilde ontdekken voordat men de werkelijke aard en de meervoudige diversiteit van de vonk realiseerde, en die nu meestal bijzondere gevallen of fouten blijken te zijn. Beter nog, Thomson vertelt op p. 416 in alle ernst de onzin van Dessaignes, volgens welk glas, hars, zijde enz. negatief elektrisch worden als ze ondergedompeld worden in kwik als de barometer stijgt en de temperatuur daalt, maar positief worden als de barometer daalt en de temperatuur stijgt; dat goud en verschillende andere metalen positief worden in de zomer door opwarming, negatief bij afkoelen, en omgekeerd in de winter; dat ze sterk elektrisch zijn als de barometer hoog staat en de wind noordelijk is, positief als de temperatuur stijgt, negatief als de temperatuur daalt, enz. Tot zover de behandeling van de feiten. Maar wat betreft de a priori speculatie geeft Thomson ons de volgende constructie van de elektrische vonk, die van niemand minder dan Faraday zelf komt:
“De vonk is een ontlading of verzwakking van de gepolariseerde inductietoestand van vele diëlektrische deeltjes, als gevolg van een bepaalde actie van een klein aantal van hen, die een zeer kleine en zeer beperkte ruimte innemen. Faraday gaat ervan uit dat de weinige deeltjes waarop de ontlading plaatsvindt, niet alleen uit elkaar worden geduwd, maar tijdelijk een eigenaardige, “zeer actieve” (highly exalted) “toestand” aannemen; dat wil zeggen dat alle krachten die hen omringen achtereenvolgens op hen worden geprojecteerd en dat ze dankzij hen een overeenkomstige intensiteit krijgen die misschien gelijk is aan de intensiteit van atomen die chemisch met elkaar verbonden zijn; dat ze dan die krachten ontladen, vergelijkbaar met die van hun eigen atomen, op een manier die ons tot nu toe onbekend was, en dat is het einde van het hele proces” (and so the end of the whole). “Het uiteindelijke effect is precies alsof een metalen deeltje de plaats van het ontladende deeltje heeft ingenomen, en het lijkt niet onmogelijk dat de werkingsprincipes in beide gevallen ooit identiek blijken te zijn.” “Ik heb,” voegt Thomson toe, “deze uitleg van Faraday in zijn eigen woorden gegeven, omdat ik het niet goed begrijp.”
Dit zal net zo goed ook de ervaring zijn van andere mensen, als ze bij Hegel lezen over de elektrische vonk ...
“de bijzondere materiële constitutie van het onder spanning staande lichaam gaat nog niet in het proces op, maar wordt daar slechts op elementaire wijze bepaald als een manifestatie van de ziel”, en elektriciteit is “de eigen boosheid, de eigen driftigheid van het lichaam”, zijn “boze zelf”, dat “in elk lichaam verschijnt wanneer het geïrriteerd is.” (Naturphilosophie, § 324, addendum)
En toch is het basisidee hetzelfde bij Hegel en Faraday. Beiden verzetten zich tegen het idee dat elektriciteit geen materie is, maar een bijzondere en aparte materie. En omdat in de vonk elektriciteit onafhankelijk lijkt te zijn, vrij, gescheiden van al het vreemde materiële substraat en toch nog voor de zintuigen waarneembaar, zorgde de toenmalige stand van de wetenschap ervoor dat de vonk moest worden begrepen als de verdwijnende manifestatie van een “kracht” die op dat moment van alle materie was bevrijd. Voor ons is het raadsel natuurlijk opgelost, omdat we weten dat “metalen deeltjes” echt tussen de metaalelektroden overspringen tijdens de vonkontlading, en dus “de speciale materie van het onder spanning staande lichaam” inderdaad “het proces binnenkomt.”
Net als bij warmte en licht is het bekend dat elektriciteit en magnetisme in eerste instantie werden beschouwd als speciale niet te wegen materialen. Wat elektriciteit betreft kwam men, zoals bekend, al snel tot de veronderstelling dat er twee tegengestelde zaken waren, twee “vloeistoffen”, een positieve en een negatieve, die in normale toestand elkaar neutraliseerden tot ze door een zogenaamde “elektrische scheidingskracht” van elkaar werden gescheiden. Men kan dan twee lichamen opladen, één met positieve elektriciteit, de andere met negatieve elektriciteit; wanneer beide verbonden zijn door een derde, geleidend lichaam, vindt de aanpassing plaats, afhankelijk van de omstandigheden, hetzij plotseling, hetzij door middel van een continue stroom. De plotselinge aanpassing leek zeer eenvoudig en voor de hand liggend, maar de stroom gaf problemen. De eenvoudigste hypothese, waarbij het lijkt alsof er telkens positieve of negatieve elektriciteit in de stroom bewoog, werd tegengesproken door Fechner en meer gedetailleerd door Weber, hij was van mening dat er in een stroomkring twee gelijke stromen van positieve en negatieve elektriciteit zijn en in tegengestelde richting en naast elkaar in kanalen stromen, tussen de weegbare moleculen van de lichamen. In de gedetailleerde wiskundige uitwerking van deze theorie komt Weber uiteindelijk ook op het punt om een functie (die ons hier niet interesseert) te vermenigvuldigen met een hoeveelheid 1/r, waar 1/r betekent “de verhouding van een eenheid elektriciteit ten opzichte van een milligram [cursief van Engels]” (Wiedemann, Lehre vom Galvanismus etc., 2e druk, III, p. 569). Maar de verhouding tot een gewichtseenheid kan zelf alleen een gewichtsverhouding zijn. Zozeer had het eenzijdig empirisme al geleid tot een gedachteloosheid dat het hier de niet-weegbaarheid van elektriciteit weegbaar maakte en in de wiskundige berekening bracht.
De door Weber afgeleide formules volstonden slechts binnen bepaalde grenzen en met name Helmholtz berekende enkele jaren geleden resultaten, strijdig met het principe van behoud van energie. Tegengesteld aan Webers hypothese van een dubbele stroom, was de hypothese van C. Neumann in 1871, nl. dat slechts één van de twee elektrische stromen, bijvoorbeeld de positieve, beweegt in de stroom, en de andere, die negatief is, stevig verbonden is met de massa van het lichaam. En Wiedemann merkt op:
“Men zou deze hypothese kunnen verenigen met die van Weber als men aan Webers veronderstelde dubbele stroom van elektrische massa’s ±1/2e, een andere ineffectieve stroom van neutrale elektriciteit toevoegt [cursief van Engels] die de hoeveelheden elektriciteit ±1/2e in de richting van de positieve stroom brengt.” (III, p. [576/]577)
Deze zin is opnieuw een aanwijzing van eenzijdig empirisme. Om de elektriciteit te laten stromen, wordt het gescheiden in positief en negatief. Maar alle pogingen om de stroom met deze twee materies te verklaren stuiten op moeilijkheden; zowel de veronderstelling dat er telkens slechts één in de stroom aanwezig is, als de hypothese dat de twee gelijktijdig in tegengestelde richtingen stromen, en ten slotte ook de derde, dat de ene stroomt en de andere rust. Als we bij deze laatste veronderstelling stilstaan – hoe verklaren we dan het onverklaarbare idee dat de negatieve elektriciteit, die toch al beweeglijk genoeg is in de elektriseermachine en de Leidse fles, stevig verenigd is met de massa van het lichaam? Naast de positieve stroom +e, die naar rechts stroomt, en de negatieve stroom -e, die naar links stroomt, laten we een derde stroom van neutrale elektriciteit ±1/2e naar rechts stromen. Eerst nemen we aan dat de twee elektrische stromen van elkaar gescheiden moeten zijn om te kunnen stromen; en om de verschijnselen die zich voordoen tijdens het stromen van de gescheiden elektrische stromen te verklaren, nemen we aan dat ze ook ongescheiden kunnen stromen. Eerst maken we een voorwaarde om een bepaald fenomeen te verklaren, en bij de eerste moeilijkheid die we tegenkomen, maken we een tweede voorwaarde die het eerste direct opheft. Welke filosofie geeft deze heren het recht om te klagen?
Naast deze opvatting over de materialiteit van elektriciteit kwam er al snel een tweede opvatting, volgens welke het werd opgevat als een loutere toestand van het lichaam, een “kracht” of, zoals we het vandaag zouden zeggen, een bijzondere vorm van beweging. We zagen hierboven dat Hegel en later Faraday deze opvatting deelden. Sinds de ontdekking van het mechanische equivalent van warmte eindelijk het begrip “warmtestof” had geëlimineerd en bewezen had dat warmte een moleculaire beweging is, was de volgende stap om ook elektriciteit volgens de nieuwe methode te behandelen en te proberen het mechanische equivalent ervan te bepalen. Dit is volledig gelukt. Met name de experimenten van Joule, Favre en Raoult hebben het mogelijk gemaakt om niet alleen het mechanische en thermische equivalent van de zogenaamde “elektromotorische kracht” van de galvanische stroom vast te stellen, maar ook de perfecte equivalentie met de energie die vrijkomt door chemische processen in de galvanische cel [Erregerzelle] en de energie die door hen wordt verbruikt in de elektrolysecel [Zersetzungszelle]. Als gevolg daarvan werd de veronderstelling dat elektriciteit een bepaalde materiële vloeistof was, steeds meer onhoudbaar.
De analogie tussen warmte en elektriciteit was echter niet perfect. De galvanische stroom verschilt nog steeds op zeer belangrijke punten van de warmtegeleiding. Het was nog steeds niet mogelijk om te zeggen wat er in de elektrisch geladen lichamen bewoog. De aanname van alleen een moleculaire trilling, zoals bij warmte, leek onvoldoende. Door de enorme snelheid van de beweging van de elektriciteit, zelfs hoger dan de lichtsnelheid, bleef het moeilijk het idee te verlaten, dat er iets materieels beweegt tussen de moleculen van het lichaam. Hier komen de laatste theorieën van Clerk Maxwell (1864), Hankel (1865), Reynard (1870) en Edlund (1872) eensgezind in het spel met de veronderstelling, die voor het eerst al in 1846 door Faraday werd gesuggereerd, dat elektriciteit een beweging is van een elastisch medium dat de hele ruimte en dus ook alle lichamen doordringt, waarvan de afzonderlijke deeltjes elkaar afstoten volgens de wet van het omgekeerde kwadraat van de afstand, met andere woorden, een beweging van etherdeeltjes, en dat de lichaamsmoleculen deelnemen aan deze beweging. De verschillende theorieën over de aard van deze beweging, die verschillen van elkaar; Maxwell, Hankel en Reynard, gebaseerd op recente studies van wervelbewegingen, verklaren het op verschillende manieren uit wervelingen, zodat de werveltheorie van de oude Descartes op steeds nieuwe gebieden in de gunst komt. We gaan niet in op de details van deze theorieën. Ze verschillen sterk van elkaar en zullen zeker nog vele veranderingen doormaken. Maar een beslissende vooruitgang lijkt te liggen in hun gemeenschappelijke fundamentele visie: elektriciteit is een beweging die reageert op de moleculen van de lichamen, van de deeltjes van de lichtgevende ether die elke weegbare materie doordringt. Deze zienswijze verzoent de twee voorgaande. Volgens deze opvatting gaat het bij elektrische verschijnselen echter om de beweging van iets materieels, anders dan bij weegbare materie. Maar dit materiële is niet de elektriciteit zelf, die in feite een vorm van beweging is, hoewel niet een vorm van de onmiddellijke, directe beweging van de weegbare materie. Terwijl de ethertheorie enerzijds een manier toont om voorbij het primitieve onhandige idee van twee tegengestelde elektrische vloeistoffen te komen, biedt het anderzijds het vooruitzicht om op te helderen wat het eigenlijke materiële substraat van de elektrische beweging is, wat voor soort ding het is wiens beweging de elektrische fenomenen veroorzaakt.
De ethertheorie heeft al een beslissend succes gehad. Zoals bekend is er minstens één punt waar elektriciteit de beweging van het licht direct verandert: het draait zijn polarisatievlak. Clerk Maxwell heeft op basis van zijn bovenstaande theorie berekend dat de elektrische specifieke verdelingscapaciteit van een lichaam gelijk is aan het kwadraat van de brekingsindex. Boltzmann heeft nu de diëlektrische coëfficiënten van verschillende niet-geleiders onderzocht en vastgesteld dat voor zwavel, hars en paraffine de vierkantswortel van deze coëfficiënten gelijk was aan hun brekingsindex. De grootste afwijking – voor zwavel – was slechts 4 %. Zo is de ethertheorie van Maxwell experimenteel bevestigd.
Het zal echter nog veel werk en tijd vergen voordat nieuwe experimenten een solide kern uit deze toch al tegenstrijdige hypothesen halen. Tot die tijd, of tot de ethertheorie wordt vervangen door een volledig nieuwe, is de elektriciteitstheorie in de onaangename positie om een formulering te moeten gebruiken waarvan het zelf toegeeft dat die verkeerd is. De hele terminologie is nog steeds gebaseerd op het idee van twee elektrische vloeistoffen. Ze spreekt nog steeds vrij ongegeneerd over “elektrische massa’s die in de lichamen stromen”, over “een scheiding van de elektriciteit in elke molecule” enz. Dit is een ongelukkige toestand die, zoals ik al zei, voor een groot deel onvermijdelijk voortvloeit uit de huidige overgangstoestand van de wetenschap, maar die ook, gezien het eenzijdige empirisme in deze tak van onderzoek, veel bijdraagt aan het behoud van de tot nu toe bestaande verwarring in het denken.
De tegenstelling tussen zogenaamde statische of wrijvingselektriciteit en dynamische elektriciteit of galvanisme kan nu als overbrugd worden beschouwd, aangezien men geleerd heeft met de elektriseermachine continue stroom te produceren en, omgekeerd, om zogenaamde statische elektriciteit te produceren via de galvanische stroom, om Leidse flessen op te laden, enz. We zullen het hier niet hebben over de subvorm van statische elektriciteit, noch over magnetisme, dat nu ook als een subvorm van elektriciteit wordt erkend. De theoretische verklaring van de fenomenen van deze groep is te vinden in de theorie van de galvanische stroom, en daar zullen we dan ook voornamelijk bij blijven.
Een constante stroom kan op verschillende manieren worden opgewekt. De mechanische beweging van een massa produceert direct, door wrijving, in eerste instantie slechts statische elektriciteit, een constante stroom slechts met grote energieverspilling; om tenminste voor het grootste deel te worden omgezet in elektrische beweging, is de tussenkomst van magnetisme nodig, zoals in de bekende magneto-elektrische machines van Gramme, Siemens en anderen. Warmte kan direct worden omgezet in elektrische stroom, bijvoorbeeld bij de verbinding tussen twee verschillende metalen. De energie die vrijkomt door chemische werking, die onder normale omstandigheden in de vorm van warmte verschijnt, wordt onder bepaalde omstandigheden omgezet in elektrische beweging. Omgekeerd, zodra de voorwaarden juist zijn, verandert de laatste in een andere bewegingsvorm: in de beweging van een massa, in geringe mate direct in de elektrodynamische aantrekkingskracht en afstoting, en in grote mate weer door tussenkomst van het magnetisme in de elektromagnetische bewegingsmachines; in warmte – overal in een stroomkring, tenzij er andere veranderingen in gang worden gezet; in chemische energie – in de elektrolysecellen en voltameters die in de stroomkring zijn aangesloten, waar de stroom verbindingen scheidt die op een andere manier tevergeefs worden aangesproken.
In al deze omzettingen geldt de basiswet van de kwantitatieve gelijkwaardigheid van de beweging in al haar transformaties. Of, zoals Wiedemann het zegt:
“Volgens de wet van het behoud van energie moeten de [mechanische] activiteiten ingezet om elektriciteit te produceren, equivalent zijn aan de activiteiten voor het produceren van alle effecten van de elektriciteit” [II, deel 2, p. 472].
De omzetting van een beweging van een massa of van warmte in elektriciteit[8] levert hier geen problemen op; het is bewezen dat de zogenaamde “elektromotorische kracht” in het eerste geval gelijk is aan de aangewende arbeid voor die beweging, in het tweede geval, “bij elke verbinding van de thermozuil direct proportioneel aan de absolute temperatuur” (Wiedemann, III, p. 482), d.w.z. met de absolute hoeveelheid warmte, gemeten bij elke verbinding. Dezelfde wet is ook van toepassing op elektriciteit, geproduceerd met behulp van chemische energie. Maar hier, althans voor de nu gangbare theorie, zijn de zaken niet zo eenvoudig. Laten we er dus dieper op ingaan.
Een van de mooiste reeks experimenten met betrekking tot de vormveranderingen van de beweging veroorzaakt door een galvanische kolom is die van Favre (1857/1858). In een calorimeter plaatste hij een Smeese zuil van 5 elementen; in een tweede plaatste hij een kleine elektromagnetische machine, waarvan de hoofdas en de riemschijf vrij uitstaken naar een willekeurige verbinding. Telkens wanneer 1 g waterstof of een oplossing van 32,6 g zink (het oude chemische equivalent van zink, gelijk aan de helft van het atoomgewicht 65,2 en uitgedrukt in gram) in de kolom werd ontwikkeld, verkreeg men de volgende resultaten:
A. De in de calorimeter ingesloten zuil, met uitsluiting van de machine: een warmteproductie 18.682 resp. 18.674 warmte-eenheden.
B. Kolom en machine verbonden in de stroomkring, en de machine beweegt niet: warmte in de keten 16.448, in machine 2.219, samen 18.667 warmte-eenheden.
C. Als B, maar de machine beweegt zonder een gewicht te tillen: warmte in de keten 13.888, in de machine 4.769, samen 18.657 warmte-eenheden.
D. Als C, maar de machine tilt een gewicht op en verricht mechanische arbeid = 131,24 kilogrammeter: warmte in de kolom 15.427, in machine 2.947, samen 18.374 warmte-eenheden; verlies t.o.v. hierboven, meer dan 18.682 = 308 warmte-eenheden. Maar de mechanische arbeid van 131,24 kilopondmeter, vermenigvuldigd met 1.000 (om het gram van het chemische resultaat naar kilogram te brengen) en gedeeld door het mechanische equivalent van de warmte = 423,5 kilogrammeter, geeft 309 warmte-eenheden, dus precies het bovengenoemde verlies, als het warmte-equivalent van de gedane mechanische arbeid.
De equivalentie van de beweging in al zijn transformaties is dus ook overtuigend bewezen voor de elektrische beweging, binnen de grenzen van de onvermijdelijke fouten. En het is ook bewezen dat de “elektromotorische kracht” van de galvanische cel niets anders is dan chemische energie die wordt omgezet in elektriciteit, en dat de cel niets anders is dan een apparaat, een apparaat dat de vrijgekomen chemische energie omzet in elektriciteit zoals een stoommachine de hitte omzet in mechanische beweging, zonder dat in beide gevallen het transformerende apparaat zelf verdere energie levert.
Hier doet zich echter een probleem voor in vergelijking met het traditionele idee. Deze denkwijze schrijft aan de cel, op grond van de contactverhoudingen in de cel tussen vloeistoffen en metalen, een “elektrische scheidingskracht” toe die evenredig is met de elektromotorische kracht en dus een bepaalde hoeveelheid energie voor een bepaalde cel vertegenwoordigt. Maar wat is de verhouding van deze inherente energiebron volgens de traditionele voorstelling, tot de cel als zodanig, zelfs zonder chemische activiteit, wat is de verhouding van deze elektrische scheidingskracht tot de energie die vrijkomt door chemische werking? En, als het een energiebron is die onafhankelijk is van deze laatste, waar komt dan de energie vandaan?
Deze vraag is, in min of meer onduidelijke vorm, het twistpunt tussen de door Volta gefundeerde contacttheorie en de chemische theorie van de galvanische stroom die direct daarna is ontstaan.
De contacttheorie verklaart de stroom door de elektrische spanningen in de cel, ontstaan door het contact van metalen met een of meer vloeistoffen – of zelfs alleen het contact van de vloeistoffen met elkaar, – vanwege hun gelijkschakeling, – of van de gescheiden en tegengestelde elektriciteit – in de stroomkring. De chemische veranderingen die zich in dit proces voordeden, werden beschouwd als secundair aan de zuivere contacttheorie. Aan de andere kant beweerde Ritter al in 1805 dat een stroom alleen kon ontstaan als de generators al voor de stroomkring chemisch op elkaar inwerken. In het algemeen wordt deze oudere chemische theorie door Wiedemann (I, p. 784) als volgt samengevat: volgens deze theorie is de zogenaamde contactelektriciteit
“mogelijk als er tegelijkertijd een echte chemische interactie is tussen de lichamen die met elkaar in contact komen of op zijn minst er een verstoring van het chemisch evenwicht is, zelfs als dit niet direct verband houdt met de chemische processen, de “neiging tot chemische actie” tussen deze lichamen.”
Zoals u ziet, wordt de vraag naar de bron van energie van de elektriciteit slechts indirect door beide partijen gesteld, omdat het op dat moment nauwelijks anders kon. Volta en zijn opvolgers vonden het acceptabel dat alleen al het contact van heterogene lichamen een continue stroom kon produceren, d.w.z. bepaalde arbeid uitvoeren zonder dat er iets tegenover staat. Ritter en zijn volgelingen zijn zich ook niet bewust van de manier waarop de chemische werking de cel in staat stelt om elektriciteit en arbeid te produceren. Maar als voor de chemische theorie van Joule, Favre, Raoult en anderen dit punt al lang is opgehelderd, geldt het tegenovergestelde voor de contacttheorie. Voor zover het is behouden, staat het in essentie nog steeds op het beginpunt. Concepten die vervlogen zijn, een tijd waarin men zich tevreden moest stellen met de op een na beste schijnbare oorzaak van enig effect, of de beweging nu uit het niets is ontstaan of niet – ideeën die direct in tegenspraak zijn met de stelling van het behoud van energie leven nog steeds voort in de huidige elektriciteitstheorie. En als dan deze ideeën, ontdaan van hun meest stotende aspecten, worden verzwakt, verdund, gecastreerd, eufemistisch verdoezeld, wordt de zaak er niet beter op: de verwarring moet alleen maar erger worden.
Zoals we hebben gezien, verklaart zelfs de oudere chemische stromingstheorie dat de contactverhoudingen van de cellen absoluut noodzakelijk zijn voor het maken van stroom; er wordt alleen beweerd dat deze contacten nooit een continue stroom produceren zonder gelijktijdige chemische werking. En het is vandaag de dag nog steeds vanzelfsprekend dat de organisatie van de contacten van de cellen precies het apparaat produceren, waarvan de vrijgekomen chemische energie wordt omgezet in elektriciteit, en dat het in wezen afhangt van deze opstelling van contacten of en hoeveel chemische energie echt wordt omgezet in elektrische beweging.
Wiedemann probeert als een eenzijdig empiricus uit de oude contacttheorie te redden wat er te redden valt. Laten we hem volgen en zien wat hij zegt.
“Zelfs als de werking van de contacten van chemisch indifferente lichamen”, zegt Wiedemann (I, p. 799), “bv. van metalen, zoals waarschijnlijk vroeger verondersteld, niet noodzakelijk is voor de zuiltheorie [cursief van Engels], noch bewezen wordt uit het feit dat Ohm er zijn wet uit afleidde, die zelfs zonder deze veronderstelling kan worden afgeleid, en Fechner, die deze wet experimenteel bevestigde, verdedigde ook de contacttheorie, is de elektrische opwekking door contact met metalen niet te ontkennen [cursief van Engels], althans volgens de huidige experimenten, zelfs als de te behalen resultaten in kwantitatief opzicht altijd onderhevig zijn aan een onvermijdelijke onzekerheid, vanwege de onmogelijkheid de oppervlakken van de lichamen absoluut schoon te houden.”
Zoals u ziet is de contacttheorie zeer bescheiden geworden. Ze geeft toe dat het niet nodig is de stroom te verklaren, noch theoretisch bewezen door Ohm, noch experimenteel bewezen door Fechner. Ze geeft zelfs toe dat de zogenaamde fundamentele experimenten, waarop ze kan vertrouwen, alleen in kwantitatief opzicht onzekere resultaten kan opleveren, en vraagt uiteindelijk alleen de erkenning dat door contact – al was het maar van metalen! - er beweging van elektriciteit is.
Als de contacttheorie het hierbij zou laten, zou er geen bezwaar zijn. Dat elektrische verschijnselen optreden wanneer twee metalen met elkaar in contact komen, een geprepareerde poot van een kikker doet trillen, een elektroscoop laat werken en andere bewegingen kan veroorzaken, is iets wat zeker zal worden toegegeven. Maar de eerste vraag is: waar komt de energie vandaan die hiervoor nodig is?
Om deze vraag te beantwoorden, moeten we volgens Wiedemann (I, p. 14)
“de volgende overwegingen maken: als de heterogene metalen platen A en B op een korte afstand van elkaar worden gebracht, trekken ze elkaar aan door de adhesiekrachten. Wanneer ze contact maken, verliezen ze de levende bewegingskracht die de aantrekkingskracht op hen uitoefent. (Als we aannemen dat de moleculen van de metalen in permanente oscillatie zijn, dan kan er, zelfs als de heterogene metalen met elkaar in contact komen, een verandering in hun oscillatie optreden met verlies van levende kracht). De verloren levende kracht wordt voor een groot deel omgezet in warmte. Een klein deel ervan wordt echter gebruikt om de voorheen geïsoleerde elektriciteit anders te verdelen. Zoals we hierboven al hebben vermeld, worden de samengebrachte lichamen geladen met gelijke hoeveelheden positieve en negatieve elektriciteit, bijvoorbeeld als gevolg van een ongelijke aantrekkingskracht van de twee elektriciteiten.” [cursief van Engels]
De bescheidenheid van de contacttheorie wordt steeds groter. Aanvankelijk wordt erkend dat de enorme elektrische scheidingskracht, die later zo’n enorm werk moet doen, op zich geen energie heeft, maar dat het niet kan functioneren zolang het niet extern van energie wordt voorzien. En dan wordt er een meer dan geringe energiebron aan toegewezen, de levende kracht van de adhesie, die pas op nauwelijks te meten afstanden effectief wordt en ervoor zorgt dat de lichamen een nauwelijks meetbare afstand overbruggen. Maar één ding is zeker: het bestaat onmiskenbaar en verdwijnt net zo onmiskenbaar bij contact. Maar zelfs deze minimale bron levert nog steeds te veel energie voor ons doel: een groot deel wordt omgezet in warmte, en slechts een klein deel wordt gebruikt voor de elektrische scheidingskracht. Hoewel bekend is dat er genoeg gevallen in de natuur zijn waarin extreem kleine impulsen extreem krachtige effecten produceren, lijkt Wiedemann zelf het gevoel te hebben dat zijn nauwelijks druppelende energiebron hier met moeite volstaat, en zoekt hij naar een mogelijke tweede bron in de veronderstelling dat de moleculaire trillingen van de twee metalen met elkaar interfereren op de contactoppervlakken. Afgezien van de andere problemen die we hier tegenkomen, hebben Grove en Gassiot bewezen dat echt contact niet eens nodig is voor het maken van elektriciteit, zoals Wiedemann zelf ons een pagina eerder vertelde. Kortom, de energiebron voor de elektrische scheidingskracht droogt steeds meer op naarmate we er langer naar kijken.
En toch kennen we tot nu toe nauwelijks een andere methode voor het opwekken van elektriciteit door middel van metaalcontact. Volgens Naumann (Allg. u. phys. Chemie, Heidelberg 1877, p. 675) “zetten de contact-elektromotorische krachten warmte om in elektriciteit”; hij vindt dat “de aanname dat het vermogen van deze krachten om elektrische beweging te produceren gebaseerd is op de hoeveelheid aanwezige warmte of, met andere woorden, een functie is van de temperatuur”, wat ook experimenteel is bewezen door Le Roux. Ook hier tasten we in het duister. De wet van de voltaïsche reeks metalen verbiedt ons onze toevlucht te nemen tot de chemische processen die in geringe mate onophoudelijk plaatsvinden aan de contactoppervlakken, altijd bedekt zijn met een dunne laag lucht en onzuiver water, een laag die wat ons betreft zo goed als onafscheidelijk is. Een elektrolyt zou een constante stroom in de kring moeten produceren; maar de elektriciteit van het metaalcontact verdwijnt zodra de stroomkring wordt gesloten. En hier komen we tot het eigenlijke punt: of en op welke manier deze “elektrische scheidingskracht”, die Wiedemann zelf eerst tot de metalen beperkte, onbekwaam verklaart om actief te zijn zonder een externe aanvoer van energie en vervolgens uitsluitend op een microscopische energiebron vertrouwt.
De voltaïsche rij schikt de metalen zo, dat elk metaal zich als elektronegatief gedraagt ten opzichte van het voorgaande, en elektropositief ten opzichte van het volgende. Als we dus een rij metalen deeltjes, zoals zink, tin, ijzer, koper, platina, enz., in deze volgorde plaatsen, kunnen we aan beide uiteinden een elektrische spanning verkrijgen. Maar als we de rij metaaldeeltjes in een stroomkring zo rangschikken dat het zink en het platina elkaar aanraken, dan wordt de spanning onmiddellijk geëgaliseerd en verdwijnt ze.
“In een stroomkring met lichamen die behoren tot de voltaïsche rij is het dus niet mogelijk continu elektriciteit te produceren.” [I, p. 45]
Wiedemann ondersteunt dit met de volgende theoretische overweging:
“Inderdaad, als er continu stroom in de kring aanwezig was, zou deze warmte opwekken in de metalen geleiders zelf, die hooguit door een afkoeling op de contactpunten van de metalen zou worden afgevoerd. In ieder geval zou het een ongelijkmatige warmteverdeling veroorzaken; ook een elektrische stroom zonder [enige] toevoer van buitenaf, zou een elektromagnetische bewegingsmachine de hele tijd kunnen aandrijven, dus arbeid verrichten, wat onmogelijk is, omdat als de metalen stevig verbonden zijn, bijvoorbeeld door te solderen, er geen wijzigingen aan de contactpunten kunnen worden aangebracht om de arbeid te compenseren.” [I, p. 44/45]
En ontevreden met het theoretische en experimentele bewijs dat alleen de contactelektriciteit van metalen geen elektriciteit opwekt, zien we dat Wiedemann zich gedwongen ziet tot een speciale hypothese om de effectiviteit ervan te elimineren, zelfs daar waar het beweerd kan worden.
Laten we dus op een andere manier proberen om van contactelektriciteit naar stroom te gaan. Laten we samen met Wiedemann ons voorstellen dat
“twee metalen, zoals een staaf van zink en koper, aan één uiteinde aan elkaar gesoldeerd, maar aan hun vrije uiteinde verbonden met een derde lichaam, dat niet elektromotorisch werkt ten opzichte van de twee metalen, maar alleen de tegenovergestelde elektriciteit geleidt op hun oppervlakken, zodat ze elkaar daarin gelijk worden, dan zou de elektrische scheidingskracht altijd het vorige spanningsverschil herstellen, waardoor er constant een elektrische stroom in de kring ontstaat die zonder vervanging zou kunnen werken, wat onmogelijk is. Derhalve kan er geen lichaam zijn dat zonder elektromotorische activiteit, in weerwil van de andere lichamen, elektriciteit geleidt.” [I, p. 45]
We zijn niet verder gekomen: de onmogelijkheid om beweging te creëren blokkeert opnieuw onze weg. Door het contact tussen chemisch indifferente lichamen, d.w.z. met de eigenlijke contactelektriciteit, brengen we nooit en te nimmer een stroom tot stand. Laten we dus nogmaals terugkeren en een derde weg nemen, die Wiedemann ons laat zien:
“Als we ten slotte een zinken en een koperen plaat onderdompelen in een vloeistof die een zogenaamde binaire verbinding bevat, die dus kunnen worden afgebroken in twee chemisch verschillende componenten die volledig verzadigd zijn, bijvoorbeeld verdund zoutzuur (H + Cl) enz., dan wordt volgens § 27 de zinkplaat negatief en de koperen positief. Wanneer de metalen worden verbonden, worden ze gelijk via het contactpunt, waardoor een stroom van positieve elektriciteit van koper naar zink vloeit. Aangezien de elektrische scheidingskracht die optreedt wanneer deze laatste metalen met elkaar in contact komen, de positieve elektriciteit op dezelfde manier voortzet, heffen de effecten van de elektrische scheidingskrachten elkaar niet op zoals in een gesloten metalen kring. Zo ontstaat een continue stroom van positieve elektriciteit, die in de stroomkring van het koper via het contactpunt met het zink naar dit laatste en van het zink via de vloeistof naar het koper stroomt. We zullen dadelijk (§ 34 [e.v.]) terugkomen op de mate waarin de individuele elektrische scheidingskrachten die in de stroomkring aanwezig zijn daadwerkelijk bijdragen aan het vormen van deze stroom. – Een combinatie van geleiders, die zo’n ‘galvanische stroom’ levert, wordt een galvanisch element genoemd, ook wel een galvanische cel, voltacel of elektrochemisch element.” [cursief van Engels] (I, p. 45)
Het wonder is voltooid. Door de loutere elektrische scheidingskracht van de contacten, die volgens Wiedemann zelfs zonder externe toevoer van energie niet kunnen werken, wordt hier ononderbroken een stroom opgewekt. En als ons niets anders aangeboden wordt ter verklaring, dan bovenstaande passage van Wiedemann, dan zou het inderdaad een compleet wonder blijven. Wat leren we hier over het proces?
1. Wanneer zink en koper worden ondergedompeld in een vloeistof die een zogenaamde binaire verbinding bevat, wordt het zink negatief en het koper positief geladen volgens § 27. – In § 27 wordt geen melding gemaakt van een binaire verbinding. Hij beschrijft alleen een eenvoudig voltaïsch element bestaande uit een zink- en een koperplaat, waartussen een met zure vloeistof bevochtigde doek wordt geplaatst, en onderzoekt vervolgens, zonder melding te maken van eventuele chemische processen, de statisch-elektrische ladingen van de twee metalen die zich voordoen. De zogenaamde binaire verbinding wordt dus via de achterdeur naar binnen gesmokkeld.
2. Wat deze binaire verbinding hier doet blijft volledig mysterieus. Het feit dat het kan ontbinden in “twee chemische componenten die volledig verzadigd zijn”, (volledig verzadigd nadat ze ontbonden zijn?!), kan ons hooguit iets nieuws leren, als het echt ontbonden is. Maar daar wordt met geen woord over gerept, dus voorlopig moeten we ervan uitgaan dat het niet ontbindt, bv. in paraffine.
3. Dus nadat het zink in de vloeistof negatief is geladen en het koper positief, brengen we ze in contact (buiten de vloeistof). “Deze elektriciteit egaliseert via het contactpunt waar, van koper naar zink, een positieve elektriciteit doorheen gaat.” Ook hier komen we niet te weten waarom alleen een stroom van “positieve” elektriciteit in één richting vloeit en niet ook een stroom van “negatieve” elektriciteit in de andere richting. We weten helemaal niet wat er van de negatieve elektriciteit zal worden, die net zo noodzakelijk is geweest als de positieve elektriciteit; de actie van de elektrische scheidingskracht bestond juist uit het feit dat het hen vrij tegenover elkaar zette. Nu wordt het plotseling onderdrukt, geëlimineerd in zekere zin, en het lijkt erop dat er alleen maar positieve elektriciteit is.
Maar dan wordt op p. 51 weer precies het tegenovergestelde gezegd, want hier “verenigt de elektriciteit zich [cursief van Engels] in één stroom”, dus zowel de negatieve als de positieve! Wie zal ons uit deze verwarring helpen?
4. “ Aangezien de elektrische scheidingskracht die optreedt wanneer deze metalen met elkaar in contact komen, ook positieve elektriciteit in dezelfde richting transporteert, heffen de effecten van de elektrische scheidingskrachten elkaar niet op, zoals in een gesloten metalen circuit. Zo ontstaat er een continue stroom”, enz. [cursief van Engels]
Dit is een beetje sterk. Want zoals we zullen zien, wijst Wiedemann ons een paar pagina’s verder (p. 52) erop dat met
“het vormen van een continue stroom ... de elektrische scheidingskracht op het contactpunt van de metalen ... inactief moet zijn” [cursief van Engels],
dat er niet alleen een stroom is, ook al wordt de positieve stroom niet in dezelfde zin voortgezet, maar wordt deze tegengesteld aan de richting van de stroom, en wordt deze zelfs in dit geval niet gecompenseerd door een bepaald deel van de scheidingskracht in de schakeling, dat wil zeggen dat de stroom weer inactief is. Hoe kan Wiedemann op p. 45 dan een elektrische scheidingskracht hebben als noodzakelijke factor in de vorming van de stroom, wanneer hij deze op p. 52 voor de duur van de stroom buiten werking stelt, en bovendien met een hypothese die speciaal voor dit doel is gemaakt?
5. “Er ontstaat dus een continue stroom van positieve elektriciteit, die in een stroomkring van het koper via het contactpunt met het zink naar dit laatste en van het zink via de vloeistof naar het koper stroomt.”
Maar zo’n continue stroom van elektriciteit zou “warmte opwekken in de geleiders zelf”, en het zou ook “een elektromagnetische bewegingsmachine kunnen aandrijven en dus arbeid verrichten”, wat onmogelijk is zonder toevoer van energie. Aangezien Wiedemann ons nog niet met één lettergreep heeft verteld of en waar een dergelijke toevoer van energie plaatsvindt, blijft de continue stroom net zo onmogelijk als in de twee hierboven onderzochte gevallen.
Niemand voelt dit meer aan dan Wiedemann. Hij vindt het dan ook wenselijk om de vele delicate punten van deze opmerkelijke uitleg over de elektriciteit zo snel mogelijk te overlopen en in ruil daarvoor de lezer een paar pagina’s te vermaken met allerlei elementaire geschiedenissen over de thermische, chemische, magnetische en fysiologische effecten van deze nog steeds mysterieuze stroom, waarbij hij voor één keer zelfs een nogal populaire toon aanslaat. Dan gaat hij plotseling verder (p. 49):
“We moeten nu onderzoeken hoe de elektrische scheidingskrachten actief zijn in een stroomkring van twee metalen en een vloeistof, bv. zink, koper, en zoutzuur.”
“We weten dat de componenten van de binaire verbinding (HCl) die zich in de vloeistof bevinden, zich scheiden wanneer de stroom erdoorheen stroomt, zodanig dat een (H) op het koper en een equivalente hoeveelheid van het andere (Cl) op het zink vrijkomt, waarbij dit laatste gecombineerd wordt met een equivalente hoeveelheid zink om ZnCl te vormen.” [cursief van Engels]
We weten het! Als we dit weten, weten we het zeker niet van Wiedemann, die, zoals we zagen, tot nu toe geen enkele lettergreep over dit proces loste. En als we al iets weten over dit proces, is het dat het niet kan verlopen op de manier die Wiedemann beschreef.
Wanneer een molecuul HCl wordt gevormd uit waterstofgas en chloorgas, komt er een hoeveelheid energie = 22.000 warmte-eenheden vrij (Jul. Thomsen). Om de binding van chloor met waterstof te breken, moet dus voor elk molecuul HCl dezelfde hoeveelheid energie van buiten komen. Waar haalt de kolom deze energie vandaan? De Wiedemann vertelt het ons niet, laten we dus eens rondkijken.
Wanneer chloor met zink wordt verbonden tot zinkchloride, komt er aanzienlijk meer energie vrij dan nodig is om het chloor van het waterstof te scheiden. (Zn, Cl2) ontwikkelt 97.210, 2 (H, Cl) 44.000 warmte-eenheden (Jul. Thomsen). En dit verklaart het proces in de kolom. Zo komt er, zoals Wiedemann ons vertelt, niet zomaar waterstof uit koper, en chloor uit zink vrij, “waarbij” zink en chloor vervolgens en per ongeluk zich met elkaar binden. Integendeel: de binding van zink met chloor is de meest essentiële basisvoorwaarde van het hele proces en zolang dit niet gebeurt, zal men tevergeefs wachten tot er waterstof op het koper vrijkomt.
Het teveel aan energie dat vrijkomt bij de vorming van een ZnCl2-molecuul boven die welke gebruikt werd om twee H-atomen uit twee HCI-moleculen vrij te geven, wordt dus in de kolom omgezet in elektrische beweging en levert alle “elektromotorische kracht” die in de stroomkring verschijnt. Het is dus niet een mysterieuze “elektrische scheidingskracht” die waterstof en chloor uit elkaar haalt zonder een eerder bewezen energiebron, het is het chemische proces dat in de kolom plaatsvindt en dat alle “elektrische scheidingskrachten” en “elektromotorische krachten” van de kring voorziet van de energie die nodig is voor hun bestaan.
Laten we dus vooralsnog stellen dat Wiedemanns tweede uitleg van de stroom, net zo weinig helpt dan de eerste, en we gaan verder met de tekst:
“Dit proces toont aan dat het gedrag van de binaire lichamen tussen de metalen niet beperkt is tot een eenvoudige overheersende aantrekkingskracht van de hele massa op een bepaalde elektriciteit, zoals het geval is voor metalen, maar dat het ook gepaard gaat met een bepaalde werking van de samenstellende elementen. Aangezien de component Cl wordt afgezet waar de stroom positieve elektriciteit de vloeistof binnenkomt, en de component H waar de negatieve elektriciteit binnenkomt, gaan we ervan uit dat een chloorequivalent in de verbinding HCl wordt geladen met een bepaalde hoeveelheid negatieve elektriciteit, waardoor de aantrekkingskracht ervan wordt veroorzaakt door de binnenkomende positieve elektriciteit. Het is de elektronegatieve component van de verbinding [cursief van Wiedemann, de andere van Engels]. Ook moet het equivalent H met positieve elektriciteit worden geladen en zo de elektropositieve component van de verbinding vormen. Deze ladingen kunnen op een vergelijkbare manier worden geproduceerd wanneer H en Cl zijn aangesloten, zoals met het zink en koper contact. Aangezien de verbinding HCl op zich niet-elektrisch is, moeten we ervan uitgaan dat de atomen van de positieve en negatieve componenten evenveel positieve als negatieve elektriciteit bevatten.
Als een zinkplaat en een koperplaat ondergedompeld zijn in verdund zoutzuur, kunnen we ervan uitgaan dat het zink een sterkere aantrekkingskracht heeft op de elektronegatieve component (Cl) dan op de elektropositieve (H). Hierdoor zouden de zoutzuurmoleculen die in contact komen met het zink zodanig worden gedeponeerd dat hun elektronegatieve componenten in de richting van het zink gaan en hun elektropositieve componenten in de richting van het koper. Aangezien de aldus gerangschikte componenten door hun elektrische aantrekkingskracht effect hebben op de componenten van de volgende moleculen HCl, wordt de hele reeks moleculen tussen de zink- en koperplaten gerangschikt, zoals hieronder.
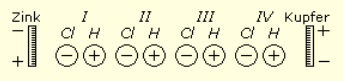
Als het tweede metaal op het positieve waterstof effect had, zoals het zink op het negatieve chloor, zou dit de instelling bevorderen. Als het een tegengesteld effect had, alleen zwakker, dan blijft de richting van de laatste in ieder geval onveranderd.
Door de invloed van de negatieve elektriciteit van de elektronegatieve component Cl in het zink, zou de elektriciteit zodanig in het zink verdeeld worden dat die delen van het zink die zich dicht bij Cl van het eerste zure atoom bevinden een positieve lading zouden hebben, terwijl die delen die verder weg liggen een negatieve lading zouden hebben. Op dezelfde manier zou in koper de negatieve elektriciteit zich eerst accumuleren in de elektropositieve component (H) van het aangrenzende waterstofchloride-atoom, en zou de positieve elektriciteit naar de verder gelegen delen worden geduwd.
“Dan zou de positieve elektriciteit in het zink zich combineren met de negatieve elektriciteit van het eerste nabije atoom Cl {1} en dit laatste met het zink [tot niet-elektrisch ZnCl]. Het elektropositieve atoom H, dat eerder met dat atoom [Cl] was verbonden, zou zich combineren met het atoom Cl van het tweede atoom HCl, met gelijktijdige verbinding van de elektriciteit in deze atomen; ook de H van het tweede atoom HCl zou zich verbinden met de Cl van het derde atoom enz., totdat uiteindelijk een atoom H vrij zou komen van het koper, waarvan de positieve elektriciteit zich zou verenigen met de verdeelde negatieve elektriciteit van het koper, zodat het ontsnapt in de niet-elektrische toestand.” Dit proces zou zich herhalen “totdat de afstoting van de elektriciteit, geaccumuleerd in de metalen platen, de elektriciteit van het waterstofchloride, dat er tegenover staat, door de chemische aantrekkingskracht van deze laatste, de metalen in evenwicht heeft gebracht”. Maar als de metalen platen geleidend met elkaar verbonden zijn, verenigen de vrije elektronen van de metalen platen zich met elkaar en kunnen de eerder genoemde processen zich opnieuw voordoen. Op deze manier zou een continue stroom van elektriciteit worden gecreëerd. – Het is duidelijk dat er een constant verlies van levende kracht is, in die zin dat de componenten van de binaire verbinding die naar de metalen verhuizen, met een bepaalde snelheid naar de metalen bewegen en dan tot rust komen, hetzij door een verbinding te vormen (ZnCl), hetzij door te ontsnappen in vrije toestand (H).” (Opmerking [van Wiedemann]: “Aangezien de baat aan levende kracht bij de scheiding van de bestanddelen Cl en H in evenwicht wordt gehouden door de levende kracht die verloren gaat in de vereniging van de laatste met de bestanddelen van de dichtstbijzijnde atomen, is de invloed van dit proces te verwaarlozen.” Dit verlies aan levende kracht is gelijk aan de hoeveelheid warmte die vrijkomt bij het zichtbaar prominente chemische proces, d.w.z. in wezen het oplossen van een equivalent van zink in het verdunde zuur. Deze waarde moet gelijk zijn aan de gebruikte arbeid voor de distributie van elektriciteit. Wanneer de elektrische stromen in één stroom worden gecombineerd, vereist het oplossen van een equivalent van zink en het scheiden van een equivalent van waterstof uit de vloeistof dus arbeid, hetzij in de vorm van warmte, hetzij in de vorm van externe arbeid, dat ook gelijkwaardig is aan de warmte die door dat chemische proces wordt opgewekt.” [I, p. 49 tot 51]
“Nemen we aan – kan – moeten aannemen – kunnen we aannemen – zou verdeeld worden – zich laden” enz. enz. Allemaal giswerk en conjunctieven, waaruit slechts drie feitelijke aanwijzingen met zekerheid kunnen worden opgevist: ten eerste, dat van de verbinding van zink en chloor nu wordt gesproken als voorwaarde voor het vrijkomen van waterstof; ten tweede, zoals we nu aan het einde leren, en als het ware terloops, dat de energie die bij dit proces vrijkomt de bron is, en inderdaad de exclusieve bron van alle energie die nodig is voor de vorming van de stroom; en ten derde, dat deze verklaring van de vorming van de stroom net zo direct in contradictie is tot de beide eerder gegeven verklaringen als dat de laatste zelf onderling tegenstrijdig zijn.
En verder:
“Voor de vorming van een continue stroom is er dus louter en alleen de elektrische scheidingskracht als gevolg van de ongelijke aantrekkingskracht en polarisatie van atomen van de binaire verbinding in de geactiveerde vloeistof van de keten, door metaalelektroden; anderzijds moet de elektrische scheidingskracht op het contactpunt van de metalen, waar geen mechanische veranderingen kunnen plaatsvinden, inactief zijn. Het feit dat deze kracht, wanneer deze bijvoorbeeld de elektromotorische activiteit van de metalen door de vloeistof tegenwerkt (zoals bij onderdompeling van tin en lood in een kaliumcyanide oplossing), niet wordt gecompenseerd door een bepaald deel van de scheidingskracht op de plaats van contact, bewijst de volledige evenredigheid van de totale elektrische scheidingskracht (en de elektromotorische kracht) in de stroomkring met het thermische equivalent van de hierboven genoemde chemische processen. Het moet daarom op een andere manier worden geneutraliseerd. De eenvoudigste manier om dit te doen zou zijn om aan te nemen dat wanneer de geactiveerde vloeistof contact maakt met de metalen, de elektromotorische kracht op een dubbele manier wordt opgewekt: ten eerste door een ongelijke aantrekkingskracht van de massa’s van de vloeistof als geheel tegen de ene of de andere elektriciteit; ten tweede door de ongelijke aantrekkingskracht van de metalen tegen de componenten die geladen zijn met tegengestelde elektrische stromen [cursief van Wiedemann, alle andere van Engels] van de vloeistof ... Als gevolg van de eerste ongelijke massa-aantrekking [tegengestelde elektriciteit], zouden de vloeistoffen zich volledig in overeenstemming met de wet van de voltaïsche rij van metalen gedragen en, in een stroomkring, zou er volledige neutralisatie van de elektrische scheidingskrachten (en elektromotorische krachten) tot nul optreden; de tweede (chemische) actie, daarentegen, zou alleen de elektrische scheidingskracht leveren die nodig is om de stroom en de elektromotorische kracht te vormen die ermee overeenkomt.” [I, p. 52/53]
Hiermee is nu gelukkig het laatste restant van de contacttheorie verwijderd uit de theorie van de stroom en tegelijkertijd het laatste restant van de eerste uitleg van Wiedemann over de stroom, p. 45. Tenslotte wordt zonder voorbehoud toegegeven dat de galvanische zuil een eenvoudig apparaat is om vrijgekomen chemische energie om te zetten in elektrische beweging, in zogenaamde elektrische scheidingskracht en elektromotorische kracht, net zoals de stoommachine een apparaat is om thermische energie om te zetten in mechanische beweging. In beide gevallen biedt het apparaat alleen de voorwaarden voor het vrijgeven en op afstand omzetten van energie, maar levert het geen energie uit zichzelf. Nu dit is vastgesteld, blijven we achter bij de derde versie van Wiedemanns verklaring van de elektriciteit: hoe worden de energietransformaties in de stroomkring van de zuil weergegeven?
“Het is duidelijk, zegt hij, dat in de kolom een constant verlies van levende kracht plaatsvindt, in die zin dat de componenten van de binaire verbinding die naar de metalen verhuizen met een bepaalde snelheid naar de metalen bewegen en dan, ofwel door het vormen van een verbinding (ZnCl) of door vrijgave (H), tot rust komen. Dit verlies is gelijk aan de hoeveelheid warmte die vrijkomt bij het chemische proces dat duidelijk in de zure oplossing optreedt, dat wil zeggen in wezen bij de afbraak van een gelijkwaardige hoeveelheid zink.” [I, p. 51]
Ten eerste, als het proces zuiver is, komt er bij het oplossen van het zink geen warmte vrij in de keten; de vrijgekomen energie wordt omgezet in elektriciteit en daarvan wordt het weer omgezet in warmte door de weerstand van de gehele gesloten kringloop.
Ten tweede is de levende kracht de helft van het product van de massa en het kwadraat van de snelheid. Dus de vorige zin zou luiden: de energie die vrijkomt wanneer een equivalent van zink wordt opgelost in verdund zoutzuur = zoveel calorieën is ook gelijk aan de helft van het product van de helft van de massa van de ionen tot het kwadraat van de snelheid waarmee ze naar de metalen migreren. Op deze wijze geformuleerd is de stelling duidelijk verkeerd; de levende kracht die ontstaat bij de verplaatsing van ionen is verre van gelijk aan de energie die vrijkomt bij het chemische proces.[9] Maar als dat zo was, zou er geen stroom mogelijk zijn, aangezien er geen energie meer over zou zijn voor de stroom in de rest van de stroomkring. Daarom wordt de opmerking toegevoegd dat de ionen tot rust komen “door een verbinding te vormen of door vrijgave”. Maar als we met het verlies van levende kracht ook rekening houden met de energietransformatie die tijdens deze twee processen plaatsvindt, zitten we nog meer vast. Want juist deze twee processen samen zijn de processen waaraan we alle vrijgekomen energie te danken hebben, zodat er geen sprake kan zijn van een verlies van levende kracht, maar alleen van een gewin.
Het is dus duidelijk dat Wiedemann zelf niet aan iets specifiek dacht in deze zin, maar dat het “verlies van levende kracht” de deus ex machina is, die hem in staat moet stellen om de fatale sprong te maken van de oude contacttheorie naar de huidige chemische verklaring van de stroom. Inderdaad, het verlies van levende kracht heeft nu zijn plicht gedaan en wordt verworpen; vanaf nu is het chemische proces in de keten onbetwistbaar de enige bron van energie voor de vorming van elektriciteit, en de enige resterende zorg van onze auteur is hoe we, op een goede manier, ons kunnen ontdoen van het laatste overblijfsel elektriciteit bij contact van chemisch indifferente lichamen, namelijk de scheidingskracht die actief is op het contactpunt van de twee metalen.
Als men de bovenstaande uitleg van Wiedemann over de vorming van elektriciteit leest, gelooft men een staaltje apologie voor zich te hebben, waarmee de hele en half-gelovige theologen zich hebben verzet tegen de filologisch-historische bijbelkritiek van Strauß, Wilke, Bruno Bauer en anderen, bijna veertig jaar geleden. De methode is hetzelfde. Dat moet wel. Want in beide gevallen is het een kwestie van het redden van de overgeleverde traditie van het wetenschappelijk denken. Namelijk het exclusieve empirisme dat het denken zich hooguit laat denken in de vorm van een wiskundige berekening, stelt zich voor dat het alleen maar om onweerlegbare feiten gaat. In werkelijkheid geeft het echter de voorkeur aan het werken met verouderde ideeën, met grotendeels verouderde resultaten van het denken van voorgangers, zoals positieve en negatieve elektriciteit, elektrische scheidingskracht, contacttheorie. Deze dienen als basis voor eindeloze wiskundige berekeningen, waarbij de hypothetische aard van de randvoorwaarden behaaglijk vergeten worden boven de strengheid van de wiskundige formulering. Dit soort empirisme is even lichtgelovig ten opzichte van de resultaten van het denken van zijn voorgangers, als sceptisch in zijn houding ten opzichte van de resultaten van het hedendaagse denken. De experimenteel vastgestelde feiten zijn onscheidbaar geworden van de overeenkomstige traditionele interpretaties; het eenvoudigste elektrische fenomeen wordt in de beschrijving vervalst, bijvoorbeeld door het binnensmokkelen van twee soorten elektriciteit; dit empirisme kan de feiten niet meer correct beschrijven omdat de traditionele interpretatie ook in de beschrijving wordt ondermijnd. In één woord, we hebben hier op het gebied van de elektriciteitstheorie een even sterk ontwikkelde traditie als bij theologie. En omdat op beide terreinen de resultaten van recent onderzoek, de vaststelling van tot nu toe onbekende of betwiste feiten en de theoretische conclusies van de oude traditie, genadeloos in strijd zijn met die oude traditie, komen de verdedigers van deze traditie in grote problemen. Ze moeten hun toevlucht nemen tot allerlei trucs, onhoudbare excuses en doofpotten voor de onverzoenlijke tegenstrijdigheden, en komen zo in een kluwen van tegenstrijdigheden zonder uitweg. Het is dit geloof in de oude elektriciteitstheorie dat Wiedemann hier in de meest onverzoenlijke tegenstelling met zichzelf verstrikt, eenvoudigweg door de hopeloze poging om de oude verklaring van de elektriciteit door “contactkracht” met de moderne rationeel te verzoenen, bij middel van het vrijkomen van chemische energie.
Men kan bezwaar maken tegen het feit dat de bovenstaande kritiek op Wiedemanns verklaring van de elektriciteit gebaseerd is op woordenziften, maar ook al is Wiedemann in het begin wat onzorgvuldig en onnauwkeurig, hij geeft uiteindelijk wel de juiste verantwoording over het behoud van energie en maakt er alles goed mee. Aan de andere kant geven we hier een ander voorbeeld, nl. zijn beschrijving van de gang van zaken in de keten: zink, verdund zwavelzuur, koper.
“Als de twee platen met elkaar verbonden zijn door een draad, ontstaat er een galvanische stroom ... het elektrolytische proces zorgt ervoor dat het water van het verdunde zwavelzuur 1 equivalent waterstof uit het koper vrijgeeft, dat in bellen ontsnapt. Aan het zink wordt een equivalent van zuurstof gevormd dat het zink oxideert tot zinkoxide, dat oplost in het omringende zuur tot zwavelhoudend zinkoxide.” (I, p. 592-593)
Om waterstofgas en zuurstofgas van water te scheiden is voor elk watermolecuul een energie = 68.924 warmte-eenheden nodig. Van waar komt dan de energie in de keten hierboven? “Door het elektrolytische proces.” En waar komt het elektrolytische proces vandaan? Geen antwoord.
Nu vertelt Wiedemann ons echter, niet één maar minstens twee keer (I, p. 472 en 614) dat “volgens recente ervaring [bij elektrolyse] het water zelf niet wordt ontbonden”, maar in ons geval het zwavelzuur H2SO4, dat enerzijds wordt afgebroken tot H2 en anderzijds tot SO3+O, waarbij H2 en O gasvormig kunnen ontsnappen. Maar dit verandert de hele aard van het proces. H2 van H2SO4 wordt direct vervangen door het tweewaardige zink en vormt zinksulfaat ZnSO4. Wat overblijft is H2 aan de ene kant en SO3+O aan de andere. De twee gassen ontsnappen in de verhoudingen waarin ze water vormen, SO3 verbindt zich met oplossingswater H2O om opnieuw H2SO4 te vormen, d.w.z. zwavelzuur. Bij de vorming van ZnSO4 wordt echter een hoeveelheid energie ontwikkeld die niet alleen voldoende is om het waterstof van het zwavelzuur te verdringen en vrij te maken, maar dat ook een aanzienlijk overschot achterlaat, dat in ons geval wordt gebruikt om stroom te maken. Het zink wacht niet op het elektrolytische proces om het te voorzien van vrije zuurstof, om eerst te oxideren en dan op te lossen in het zuur. Integendeel. Het komt direct in het proces terecht, dat alleen door deze deelname van het zink tot stand komt.
We zien hier hoe verouderde chemische ideeën de verouderde contactideeën kunnen helpen. Volgens de meer recente opvatting is een zout een zuur waarin waterstof wordt vervangen door een metaal. Het hier te onderzoeken proces bevestigt deze zienswijze: de directe verwijdering van waterstof uit het zuur door het zink verklaart de energieomzetting volledig. De oudere opvatting, die Wiedemann volgt, beschouwt een zout als een verbinding van een metaaloxide met een zuur en spreekt daarom van zwavelzuur zinkoxide in plaats van zinksulfaat. Maar om zwavelzuur zinkoxide in onze zink en zwavelzuur keten te krijgen, moet het zink eerst geoxideerd worden. Om het zink snel genoeg te oxideren, moeten we vrije zuurstof hebben. Om vrije zuurstof te hebben, moeten we ervan uitgaan – want er verschijnt waterstof op het koper – dat het water wordt ontbonden. Om het water te ontbinden hebben we een enorme hoeveelheid energie nodig. Hoe komen we aan deze energie? Gewoon “door het elektrolytische proces”, dat maar opnieuw kan worden opgestart als het chemische eindproduct, het “zwavelzuur-zinkoxide”, zich begint te vormen. Het kind baart de moeder.
Ook hier keert Wiedemann het hele proces volledig om en zet het op zijn kop. En dat komt omdat Wiedemann de actieve en passieve elektrolyse, twee direct tegenovergestelde processen, eenvoudig weg als elektrolyse op een hoop gooit.
Tot nu toe hebben we alleen de processen in de keten bestudeerd, d.w.z. het proces waarbij een overschot aan energie vrijkomt door chemische werking en wordt omgezet in elektriciteit door de organisatie van de keten. Dit proces kan ook omgekeerd worden: de elektriciteit van de continue stroom die in de keten wordt geproduceerd uit chemische energie kan op zijn beurt weer worden omgezet in chemische energie in een elektrolysecel, ingebracht in de stroomkring. Beide processen zijn blijkbaar tegengesteld aan elkaar; als we het eerste als chemisch-elektrisch beschouwen, is het tweede elektrochemisch. Beide kunnen op dezelfde stoffen in dezelfde kring werken. Zo kan in een ingeschakelde elektrolysecel de keten van gaselementen, waarvan de stroom wordt opgewekt door waterstof en zuurstof te combineren tot water, waterstofgas en zuurstofgas leveren in de verhouding waarin ze water vormen. De gebruikelijke aanpak vat deze twee tegengestelde processen samen onder één term: elektrolyse, en maakt zelfs geen onderscheid tussen actieve en passieve elektrolyse, een actieve vloeistof en een passieve elektrolyt. Zo behandelt Wiedemann elektrolyse in het algemeen op 133 pagina’s en voegt aan het eind enkele opmerkingen toe over “elektrolyse in de keten”, waarvan de processen in echte ketens slechts een klein gedeelte van de 17 pagina’s van deze sectie, in beslag nemen. Het volgende Theorie van de Elektrolyse vermeldt niet eens deze tegenstelling tussen keten en elektrolysecel, en iedereen die in het volgende hoofdstuk “Invloed van elektrolyse op de geleidingsweerstand en de elektromotorische kracht in de gesloten kring”, zoekt naar een behandeling van de energieomzettingen in de stroomkring zal bitter teleurgesteld zijn.
Laten we nu kijken naar het onweerstaanbare “elektrolytische proces”, dat H2 van O kan scheiden zonder enige zichtbare aanvoer van energie en dat in de betreffende delen van het boek dezelfde rol speelt als de mysterieuze “elektrische scheidingskracht” eerder deed.
“Naast het primaire, zuiver elektrolytische proces om de ionen te scheiden, zijn er nu een aantal secundaire, zuiver chemische processen die volledig onafhankelijk zijn van het primaire proces en die worden veroorzaakt door de ionen die door de stroom worden gescheiden. Dit effect kan plaatsvinden op het materiaal van de elektroden en op het ontbonden lichaam, in de oplossingen ook op het oplosmiddel.” (I, p. 481)
Laten we teruggaan naar bovengenoemde keten: zink en koper in verdund zwavelzuur. Hier zijn volgens Wiedemanns eigen verklaring de ionen H2 en O gescheiden van het water. Bijgevolg is de oxidatie van zink en de vorming van ZnSO4 een secundair, zuiver chemisch proces, onafhankelijk van het elektrolytisch proces, hoewel het het primaire proces mogelijk maakt. Laten we nu in detail kijken naar de verwarring die noodzakelijkerwijs moet ontstaan door deze omkering van het echte proces.
Laten we eerst kijken naar de zogenaamde secundaire processen in de elektrolysecel, waarvan Wiedemann enkele voorbeelden geeft.[10] (p. 481/482)
I. Elektrolyse van zwavelzuurnatrium (Na2SO4) opgelost in water. Dit “ontbindt... in 1 equivalent SO3 + O... en 1 equivalent Na. ... Dit laatste reageert echter op het oplossingswater en scheidt 1 equivalent H ervan, terwijl 1 equivalent natriumhydroxide [NaOH] wordt gevormd en opgelost in het omringende water”.
De vergelijking is:
Na2SO4 + 2H2O = O + SO3 + 2NaOH + 2H.
In dit voorbeeld zou de ontbinding inderdaad
Na2SO4 = Na2 + SO3 + O
het primaire, elektrochemische zijn, en de verdere reactie
Na2 + 2H2O = 2NaOH + 2H
het secundaire, zuiver chemisch proces. Maar dit secundaire proces vindt direct plaats bij de elektrode, waar de waterstof verschijnt, en de zeer aanzienlijke hoeveelheid energie die vrijkomt (111.810 warmte-eenheden voor Na, O, H, aq. volgens Jul. Thomsen) wordt daarom, in ieder geval voor het grootste deel, omgezet in elektriciteit, en slechts een deel wordt direct omgezet in warmte in de cel. Dit laatste kan echter ook gebeuren met de chemische energie die direct of primair in de kolom vrijkomt.
De hoeveelheid energie die op die manier ter beschikking wordt gesteld en in elektriciteit wordt omgezet, wordt echter afgetrokken van de hoeveelheid die de elektriciteit moet leveren voor de verdere ontbinding van Na2SO4. Als de omzetting van natrium in oxidehydraat op het eerste moment van het totale proces als secundair proces verschijnt, wordt het vanaf het tweede moment een essentiële factor van het totale proces en is het dus niet langer secundair.
Maar nu is er nog een derde proces in deze elektrolysecel: SO3, als het zich niet bindt met het metaal van de positieve elektrode, die weer energie zou vrijgeven, bindt zich met H2O om H2SO4, zwavelzuur, te vormen. Deze reactie vindt echter niet noodzakelijkerwijs direct bij de elektrode plaats, en de hoeveelheid vrijgekomen energie (21.320 warmte-eenheden, J. Thomsen) wordt daarom volledig of grotendeels in warmte in de cel zelf omgezet, en hooguit wordt een zeer klein deel als elektriciteit aan de stroom afgegeven. Het enige echt secundaire proces dat in deze cel plaatsvindt, wordt niet door Wiedemann vermeld.
II: “Als een kopersulfaatoplossing [CuSO4 + 5H2O] wordt geëlektrolyseerd tussen een positieve koperelektrode en een negatieve platina-elektrode, dan – terwijl tegelijk een oplossing van zwavelzuur wordt ontbonden in dezelfde stroomkring – dan komt op de negatieve platina-elektrode een equivalent van koper voor een equivalent van ontbonden water vrij; op de positieve elektrode moet een equivalent SO4 verschijnen; maar dit bindt zich met het koper van de elektrode om een CuSO4-equivalent te vormen, dat oplost in het water van de elektrolyse-oplossing.” (I, p. 481)
We moeten ons dus het proces in de moderne chemische terminologie op deze manier voorstellen: Cu slaat neer op het platina; het vrijgekomen SO4, dat niet als zodanig kan bestaan, vervalt tot SO3+O, dat vrij komt; SO3 absorbeert H2O uit het oplossingswater en vormt H2SO4, dat weer samen met het koper van de elektrode CuSO4 vormt, waardoor H2 vrij komt. We hebben hier, precies gesproken, drie processen: 1. scheiding van Cu en SO4; 2. SO3 + O + H2O = H2SO4 + O; 3. H2SO4 + Cu = H2 + CuSO4. Het ligt voor de hand om het eerste als primair te beschouwen, de andere twee als secundair. Maar als we vragen stellen over de energieomzettingen, vinden we dat het eerste volledig wordt gecompenseerd door een deel van het derde proces: de scheiding van koper en SO4 door beide te herenigen bij de andere elektrode. Als we de energie die nodig is om het koper van de ene naar de andere elektrode te verplaatsen buiten beschouwing laten en ook het onvermijdelijke, niet precies te bepalen energieverlies in de keten door omzetting in warmte, hebben we hier het geval dat het zogenaamde primaire proces geen energie aan de stroom onttrekt. De stroom levert uitsluitend energie om de nog meer indirecte scheiding van H2 en O mogelijk te maken, wat het echte chemische resultaat van het hele proces blijkt te zijn – d.w.z. om een secundair of zelfs tertiair proces uit te voeren.
In beide bovenstaande voorbeelden heeft het onderscheid tussen primaire en secundaire processen, net als in andere gevallen, een onmiskenbare relatieve rechtvaardiging. Zo lijkt in beide gevallen onder andere water te worden afgebroken en worden de elementen van het water op de tegenoverliggende elektroden afgezet. Omdat volgens de laatste ervaringen absoluut zuiver water zo dicht mogelijk bij het ideaal van een niet-geleider, dus ook van een niet-elektrolyt, komt, is het belangrijk te bewijzen dat in deze en soortgelijke gevallen het water niet direct elektrochemisch wordt afgebroken, maar dat de elementen van het water worden gescheiden van het zuur, waaraan de vorming van het oploswater wel moet bijdragen.
III. “Elektrolyseert men tegelijkertijd in twee U-vormige buizen ... zoutzuur [HCl + 8 H2O] ... en met behulp van een positieve zinkelektrode in de ene buis en koper in de andere, dan lost de hoeveelheid zink 32,53 op in de eerste buis en de hoeveelheid koper 2 × 31,7 in de tweede.” [I, p. 482]
Laten we het koper voorlopig buiten beschouwing en het bij zink houden. Het primaire proces is hier de ontbinding van HCl, het secundaire is de oplossing van Zn.
Volgens deze opvatting voorziet de stroom van buitenaf de elektrolysecel van de energie die nodig is voor de scheiding van H en Cl, en na deze scheiding verenigt Cl zich met Zn, waardoor een hoeveelheid energie vrijkomt die wordt afgetrokken van de energie die nodig is voor de scheiding van H en Cl; de stroom hoeft dus alleen maar het verschil te leveren. Tot nu toe is alles perfect, maar als we de twee hoeveelheden energie nader bekijken, zien we dat de hoeveelheid energie die vrijkomt bij de vorming van ZnCl2 groter is dan de hoeveelheid energie die wordt verbruikt bij de scheiding van 2HCl, zodat de stroom niet alleen geen energie hoeft te leveren, maar juist energie ontvangt. We hebben niet langer een passieve elektrolyt voor ons, maar een geladen vloeistof, geen elektrolysecel, maar een keten die de stroom vormende zuil met een nieuw element versterkt; het proces dat we als secundair moeten beschouwen wordt absoluut primair, wordt de energiebron van het hele proces en maakt het onafhankelijk van de stroom die aan de zuil wordt geleverd.
Hier zien we duidelijk de bron van alle verwarring in de theoretische uiteenzetting van Wiedemann. Wiedemann gaat uit van elektrolyse, actief of passief, keten of elektrolysecel, het is allemaal hetzelfde: een doosje pleisters is een doosje pleisters, zoals de oude majoor zei tegen de “eerstejaars” dokter in de filosofie. En omdat de elektrolyse veel gemakkelijker te bestuderen is in de elektrolysecel dan in de keten, begint hij bij de elektrolysecel, hij maakt de processen die er plaatsvinden, en de gedeeltelijk gerechtvaardigde verdeling in primair en secundair, tot maat van de tegengestelde processen in de keten, en hij merkt niet eens wanneer de elektrolysecel onder zijn ogen verandert in een keten. Daarom kan hij deze zin schrijven:
“De chemische affiniteit van de ontbonden stoffen met de elektroden heeft geen invloed op het eigenlijke elektrolytische proces.” (I, p. 471)
een zin die in deze absolute vorm, zoals we zagen, totaal fout is. Vandaar zijn drievoudige theorie van de stroom: ten eerste, de ouderwetse theorie van het zuivere contact; ten tweede, de meer abstracte theorie van de elektrische scheidingskracht, die op onverklaarbare wijze zichzelf of het “elektrolytische proces” van de energie voorziet om H en Cl in de keten te splitsen en stroom te vormen; ten slotte de moderne, chemisch-elektrische, die de bron van deze energie staaft in de algebraïsche som van alle chemische activiteit in de keten. Net zoals hij niet merkt dat de tweede verklaring de eerste verwerpt, vermoedt hij niet dat de derde op zijn beurt de tweede verwerpt. Integendeel, het principe van behoud van energie is van buitenaf toegevoegd aan de oude theorie, door routine overgeleverd, aangezien men een nieuw meetkundig theorema aan de vorige koppelt. Hij vermoedt niet dat dit principe een herziening vereist van de gehele traditionele manier van kijken, in deze en alle andere gebieden van de wetenschap. Wiedemann merkt dit eenvoudigweg op in zijn verklaring van de elektriciteit, en legt ze dan rustig terzijde en brengt het pas aan het eind van het boek, in het hoofdstuk over de werking van elektriciteit, weer ter sprake. Zelfs in de theorie van de activiteit van elektriciteit door contact (I, p. 781 e.v.) speelt het behoud van energie in relatie tot de hoofdzaak, geen enkele rol en wordt het slechts af en toe gebruikt om secundaire punten te verduidelijken; het is en blijft een “secundair proces”.
Laten we terugkeren naar voorbeeld III. Waar dezelfde stroom werd gebruikt om zoutzuur in twee U-vormige buizen te elektrolyseren, maar in de ene zink, en koper als de positieve elektrode in de andere. Volgens de fundamentele elektrolytische wet van Faraday, ontbindt dezelfde galvanische stroom equivalente hoeveelheden elektrolyten in elke cel, en de hoeveelheden stoffen die op beide elektroden worden afgezet zijn ook in verhouding tot hun equivalenten (I, p. 470). In het bovenstaande geval bleek dat in de eerste buis de hoeveelheid zink 32,53 was opgelost, in de andere de hoeveelheid koper 2 × 31,7.
“Het is echter”, vervolgt Wiedemann, “geen bewijs van de gelijkwaardigheid van deze waarden. Deze worden alleen gevonden bij zeer lage concentraties, waarbij zinkchloride wordt gevormd ... aan de ene kant en koperchloride ... aan de andere kant. In het geval van een hoger concentraat, voor dezelfde hoeveelheid opgelost zink, zou de hoeveelheid opgelost koper toenemen met de vorming van een toenemende hoeveelheid chloride ... zou de hoeveelheid opgelost koper dalen tot 31,7.”
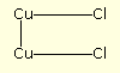
Van zink is bekend dat het slechts één chloorverbinding vormt, zinkchloride ZnCl2; koper daarentegen vormt er twee, koperchloride CuCl2 en koperchloride Cu2Cl2. De gang van zaken is zo, dat de zwakke stroom op elke twee chlooratomen twee koperatomen van de elektrode splitst, die verbonden blijven met één van hun twee verbindingen, terwijl hun twee vrije verbindingen combineren met de twee chlooratomen:
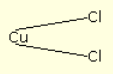
Als de stroom daarentegen sterker wordt, splitst hij de koperatomen volledig en bindt hij ze elk met twee chlooratomen:
Bij middelsterke stromen worden beide verbindingen naast elkaar gevormd. Het is dus alleen de stroomsterkte die de vorming van de ene of de andere verbinding veroorzaakt, en het proces is dus in wezen elektrochemisch, indien dit woord iets betekent. Wiedemann verklaart echter uitdrukkelijk dat het om een secundair, d.w.z. niet om een elektrochemisch, maar om een zuiver chemisch product gaat.
Het bovenstaande experiment is van Renault (1867) en behoort tot een hele reeks soortgelijke experimenten waarbij dezelfde stroom in een U-buis door een zoutoplossing (positieve elektrode – zink), in een andere cel door afwisselende elektrolyten met verschillende metalen als positieve elektroden werd uitgevoerd. De hoeveelheden van de andere metalen die hier zijn opgelost voor elk zink-equivalent, divergeren zeer sterk, en Wiedemann geeft de resultaten van een hele reeks experimenten, die echter in feite meestal chemisch voor de hand liggen en niet anders kunnen zijn. Zo werd bijvoorbeeld voor 1 equivalent zink slechts 2/3 equivalent goud opgelost in zoutzuur. Dit kan alleen maar verrassend lijken als men zich, net als Wiedemann, aan de oude equivalente gewichten houdt en voor zinkchloride: ZnCl schrijft, volgens welke zowel het chloor als het zink slechts met één verbinding in het chloride voorkomt. In werkelijkheid zijn er twee chlooratomen (ZnCl2) per zinkatoom, en zodra we deze formule kennen, zien we meteen dat bij de bovenstaande bepaling van de equivalenten het chlooratoom als eenheid moet worden aangenomen en niet het zinkatoom. Maar de formule voor goudchloride is AuCl3, volgens welke het duidelijk is dat 3ZnCl2 evenveel chloor bevat als 2AuCl3 en dat dus alle primaire, secundaire en tertiaire processen in de keten of cel nodig zullen zijn om niet meer en niet minder dan 2/3 van het gewicht van goud om te zetten in goudchloride voor elk deel van het gewicht van zink dat wordt omgezet in zinkchloride. Dit geldt absoluut, tenzij de verbinding AuCl ook met galvanische middelen zou kunnen worden geproduceerd, in welk geval 2 equivalent goud zou moeten worden opgelost voor 1 equivalent zink, en waarbij soortgelijke variaties afhankelijk van de stroomsterkte zouden kunnen optreden als in het geval van koper en chloor. De waarde van de experimenten van Renault is dat ze laten zien hoe de wet van Faraday wordt bevestigd door feiten die daarmee in tegenspraak lijken te zijn. Maar wat ze geacht worden bij te dragen aan het begrip van de secundaire processen in de elektrolyse, is niet te zien.
Het derde voorbeeld van Wiedemann leidde ons alweer van de elektrolysecel naar de keten. En inderdaad, de keten is veruit het meest interessante, zodra de elektrolytische processen zijn bestudeerd in relatie tot de omzetting van energie die er plaatsvindt. Zo komen we vaak kolommen tegen waarin de chemisch-elektrische processen in directe tegenspraak zijn met de wet van behoud van energie en tegengesteld lijken aan de chemische verwantschap.
Volgens de metingen van Poggendorff levert de keten: zink, geconcentreerde zoutoplossing, platina, een stroomsterkte van 134,6.{2} We hebben hier een vrij behoorlijke hoeveelheid elektriciteit, 1/3 meer dan in het Daniell-element. Waar komt de energie vandaan die hier als elektriciteit verschijnt? Het “primaire” proces is de vervanging van natrium uit de chloorverbinding door het zink. Maar in de normale chemie is het niet het zink dat het natrium vervangt, maar omgekeerd vervangt het natrium het zink uit chloor en andere verbindingen. Het “primaire” proces kan bovengenoemde hoeveelheid energie bij lange na niet aan de stroom leveren, integendeel, het vereist een externe aanvoer van energie om tot stand te komen. Met alleen het “primaire” proces zitten we dus alweer vast. Laten we dus kijken naar het echte proces. Daar vinden we dat de omzetting niet
Zn + 2 NaCl = ZnCl2 + 2 Na,
is, maar
Zn + 2 NaCl + 2 H2O = ZnCl2 + 2 NaOH + H2.
Met andere woorden, het natrium wordt niet vrij gescheiden bij de negatieve elektrode, maar geoxideerd, zoals in voorbeeld I hierboven. (pp. [419/420])
Om de omzetting van energie in dit proces te berekenen geeft de vaststelling van Julius Thomsen ons op zijn minst enkele aanwijzingen. Volgens deze gegevens hebben we energie vrijgemaakt bij de verbindingen:
(Zn, Cl2) = 97.210, (ZnCl2, aqua) = 15.630
| Totaal opgelost zinkchloride | = | 112.840 | Warmte-eenheden |
| 2 (Na, O, H, aqua) | = | 223.620 | " " |
| 336.460 | " " | ||
| Min het energieverbruik tijdens de scheidingen: | |||
| 2 (Na, Cl, aqua) | = | 193.020 | Warmte-eenheden |
| 2 (H2, O) | = | 136.720 | " " |
| 329.740 | " " | ||
| Overtollig vrijgekomen energie | 6.720 | Warmte-eenheden |
Deze som is blijkbaar te klein voor de verkregen stroom, maar voldoende om de scheiding van natrium en chloor enerzijds en de vorming van stroom anderzijds te verklaren.
Hier hebben we een treffend voorbeeld voor het feit dat het onderscheid tussen primaire en secundaire processen vrij relatief is en leidt naar een reductio ad absurdum [bewijs uit het ongerijmde], zodra we het absoluut nemen. Het primaire elektrolytische proces alleen, kan niet alleen geen elektriciteit opwekken, maar kan zelfs niet zelfvoorzienend zijn. Het secundaire, zogenaamd puur chemische proces is wat het primaire proces in de eerste plaats mogelijk maakt en bovendien het hele overschot aan energie voor het vormen van stroom levert. In werkelijkheid is het dus het primaire proces en het andere het secundaire. Toen de starre verschillen en tegenstellingen, zoals die door metafysici en metafysische natuurvorsers werden voorgesteld, door Hegel dialectisch werden omgedraaid in hun tegengestelden, werd gezegd dat hij hun woorden had verdraaid. Maar als de natuur hetzelfde doet als de oude Hegel, dan is het zeker tijd om de zaak nader te onderzoeken.
Het is correcter om ze als secundaire processen te zien die onafhankelijk zijn en er los van staan, hoewel de activiteit er is als gevolg van het chemisch-elektrische proces in de kolom of het elektrochemische proces van de elektrolysecel, d.w.z. op enige afstand van de elektroden. De omzettingen van energie in dergelijke secundaire processen, komen dus niet in het elektrische proces terecht; ze onttrekken geen energie en leveren ook niet direct energie. Dergelijke processen komen zeer vaak voor in de elektrolysecel; we hebben dit hierboven onder voorbeeld I besproken, een voorbeeld van de vorming van zwavelzuur tijdens de elektrolyse van natriumsulfaat. Maar dat is hier van minder belang. Aan de andere kant is hun aanwezigheid in de kolom van groter praktisch belang. Zelfs als ze niet direct energie toevoegen of onttrekken uit het chemisch-elektrische proces, veranderen ze de som van de beschikbare energie in de kolom en beïnvloeden ze deze dus indirect.
Deze omvatten, naast de daaropvolgende chemische reacties van de gebruikelijke soort, de verschijnselen die optreden wanneer de ionen worden afgescheiden bij de elektroden in een andere staat dan deze waarin ze normaal gesproken vrij voorkomen, en wanneer ze dan pas in de laatste overgaan nadat ze zich van de elektroden hebben verwijderd. De ionen kunnen een andere dichtheid of aggregatietoestand aannemen. Ze kunnen ook belangrijke veranderingen ondergaan in hun moleculaire bouw, en dit is het meest interessante geval. In al deze gevallen komt de secundaire chemische of fysische verandering van de ionen op een bepaalde afstand van de elektroden overeen met een analoge warmteverandering; in de meeste gevallen komt warmte vrij, in sommige gevallen wordt het verbruikt. Het spreekt voor zich dat deze warmteverandering zich in eerste instantie beperkt tot de plaats waar ze zich voordoet: de vloeistof in de kolom of de elektrolysecel warmt op of koelt af, de rest van de stroomkring blijft onaangeroerd. Daarom wordt deze warmte lokale warmte genoemd. De chemische energie die beschikbaar is voor omzetting in elektriciteit wordt dus verminderd of verhoogd met het equivalent van deze positieve of negatieve lokale warmte die in de kolom wordt opgewekt. In een kolom met waterstofperoxide en zoutzuur werd volgens Favre 2/3 van de totale vrijgekomen energie als lokale warmte verbruikt, terwijl het Grove-element na beëindiging aanzienlijk afkoelde en zo energie van buitenaf aan de stroomkring toevoegde door warmteabsorptie. We zien dus dat deze secundaire processen ook een effect hebben op het primaire proces. We mogen doen wat we willen, het onderscheid tussen primaire en secundaire processen blijft relatief en wordt in de interactie van beide regelmatig opgeheven. Als we dit vergeten, als we zulke relatieve tegenstellingen als absoluut behandelen, zullen we uiteindelijk vastlopen in tegenstrijdigheden, zoals hierboven gezien.
In de elektrolytische afscheiding van gassen is het bekend dat de metaalelektroden beslaan met een dun laagje gas; hierdoor neemt de stroomsterkte af tot de elektroden verzadigd zijn met gas, waarna de verzwakte stroom weer constant wordt. Favre en Silbermann hebben bewezen dat de lokale warmte ook in een dergelijke elektrolysecel ontstaat, wat alleen kan worden veroorzaakt door het feit dat de gassen niet bij de elektroden vrijkomen in de staat waarin ze normaal gesproken voorkomen, maar dat ze na hun scheiding van de elektroden alleen in deze normale staat worden gebracht door een verder proces dat verband houdt met de warmteontwikkeling. Maar wat is de toestand van de gassen bij de elektroden? Hier kan men niet voorzichtiger zijn dan Wiedemann. Hij noemt het “een bepaalde”, een “allotrope”, een “actieve” toestand, en in het geval van zuurstof soms zelfs een “geozoniseerde” toestand. Waterstof wordt veel mysterieuzer besproken. Af en toe breekt het beeld door dat ozon en waterstofperoxide de vormen zijn waarin deze “actieve” toestand wordt gerealiseerd. Onze auteur is echter zo geobsedeerd door ozon dat hij zelfs zo ver gaat om de extreem elektronegatieve eigenschappen van bepaalde peroxiden te verklaren door het feit dat ze “mogelijk een deel van de zuurstof in de geozoniseerde toestand bevatten [cursief van Engels]”! (I, p. 57) Zeker, tijdens de zogenaamde afbraak van water worden zowel ozon als waterstofperoxide gevormd, maar slechts in kleine hoeveelheden. We hebben geen reden om aan te nemen dat in dit geval de lokale warmte wordt bepaald door het feit dat min of meer significante hoeveelheden van de twee bovengenoemde combinaties eerst worden geproduceerd en vervolgens afgebroken. We kennen niet de warmte van het vormen van ozon (O3) uit de vrije zuurstofatomen. Volgens Berthelot = 21.480 waterstofperoxide uit H2O (vloeibaar) + O; het realiseren van deze combinatie in grote hoeveelheden zou dus veel extra energie vergen (ongeveer 30 % van de energie die nodig is voor het scheiden van H2 en O), wat voor de hand moet liggen of kan worden aangetoond. Tot slot zouden ozon en waterstofperoxide alleen voor zuurstof zorgen (als we afzien van stroomomkeringen, waarbij beide gassen samenkomen bij dezelfde elektrode), maar niet van waterstof. En toch ontsnapt waterstof, zelfs in een “actieve” toestand, op zo’n manier dat het combineert: kaliumnitraatoplossing tussen platina-elektroden, waarbij stikstof gescheiden wordt van het zuur om direct ammoniak te vormen.
In feite bestaan al deze problemen en zorgen niet. Het vrijgeven van lichamen “in actieve toestand” is geen monopolie van het elektrolytische proces. Elke chemische ontleding doet hetzelfde. Het scheidt in eerste instantie het vrijgekomen chemische element in de vorm van vrije atomen O, H, N enz., die pas na het vrijkomen van de moleculen O2, H2, N2 enz. tot moleculen kunnen worden samengevoegd en een bepaalde hoeveelheid energie vrijgeven met deze verbinding, die nog niet is vastgesteld en als warmte verschijnt. Maar tijdens een minuscuul moment, wanneer de atomen vrij zijn, zijn ze drager van alle energie die ze kunnen opnemen; in het bezit van hun maximale energie, zijn ze vrij om elke verbinding aan te gaan die zich aandient. Ze zijn dus “in actieve toestand” tegenover de moleculen O2, H2, N2, die al een deel van die energie hebben afgegeven en geen binding met andere elementen kunnen aangaan zonder dat deze afgegeven hoeveelheid energie weer van buitenaf wordt aangevuld. We hoeven dus niet onze toevlucht te nemen tot ozon en waterstofperoxide, die zelf producten van die actieve staat zijn. Wij kunnen bijvoorbeeld de bovengenoemde vorming van ammoniak in de elektrolyse van kaliumnitraat zonder een kolom uitvoeren door eenvoudigweg salpeterzuur of een nitraatoplossing aan een vloeistof toe te voegen waarin waterstof door chemische processen vrijkomt. De actieve toestand van waterstof is in beide gevallen hetzelfde. Maar het interessante aan het elektrolytische proces is dat hier het minuscule bestaan van de vrije atomen begrijpelijk wordt. Het proces is verdeeld in twee fasen: de elektrolyse levert vrije atomen aan de elektroden, maar hun verbinding met de moleculen vindt plaats op enige afstand van de elektroden. Hoe oneindig klein deze afstand ook is, in verhouding tot de massa, het is toch voldoende om grotendeels te voorkomen dat de energie die vrijkomt bij de vorming van de moleculen, dat die wordt gebruikt voor het elektrische proces; dus de omzetting ervan in warmte teweegbrengt – de lokale warmte in de kolom. Hierdoor staat vast dat de elementen als vrije atomen werden afgescheiden en een moment als vrije atomen in de keten bestonden. Dit feit, dat in de zuivere chemie alleen door theoretische conclusies kan worden vastgesteld, wordt ons hier experimenteel bewezen, voor zover dit mogelijk is zonder de zintuiglijke waarneming van de atomen en de moleculen. Hierin ligt het grote wetenschappelijke belang van de zogenaamde lokale warmte van de kolom.
De omzetting van chemische energie in elektriciteit door middel van een keten, is een proces waarvan we bijna niets weten en dat we waarschijnlijk beter zullen leren kennen als de modus operandi van de elektrische beweging zelf beter bekend is.
Aan de keten wordt een “elektrische scheidingskracht” toegekend die voor elke afzonderlijke keten wordt bepaald. Zoals we in het begin hebben gezien, geeft Wiedemann toe dat deze elektrische scheidingskracht geen specifieke vorm van energie is. Integendeel, het is in de eerste plaats niets anders dan het vermogen, de eigenschap van een keten, om een bepaalde hoeveelheid vrijgekomen chemische energie om te zetten in elektriciteit in een tijdseenheid. Deze chemische energie neemt nooit de vorm aan van “elektrische scheidingskracht”, maar neemt integendeel onmiddellijk en direct de vorm aan van de zogenaamde “elektromotorische kracht”, d.w.z. de elektrische beweging. Als men in het gewone leven spreekt over de kracht van een stoommachine in de zin dat deze in staat is om een bepaalde hoeveelheid warmte om te zetten in een beweging van een massa in een tijdseenheid, dan is er geen reden om deze verwarring van termen in de wetenschap in te voeren. We kunnen net zo goed spreken van de verschillende krachten van een pistool, een karabijn, een geweer met een gladde loop en een donderbus, want ze hebben verschillende schietafstanden met dezelfde kruitlading en hetzelfde kogelgewicht. Maar hier is de foute uitdrukking heel duidelijk. Iedereen weet dat de ontsteking van de kruitlading de kogel voortstuwt, en dat het verschillende bereik van de wapens alleen te wijten is aan een grotere of kleinere verspilling van energie, afhankelijk van de lengte van de loop, de speling van de kogel in de loop, en de vorm. En hetzelfde geldt voor de stoomkracht en voor de elektrische scheidingskracht. Twee stoommachines – onder verder gelijkblijvende omstandigheden, d.w.z. dat de hoeveelheid energie die in beide perioden vrijkomt gelijk is – of twee galvanische ketens, met dezelfde voorwaarden, verschillen in hun werkprestaties alleen door een grotere of kleinere energieverspilling. En als alle legers tot nu toe de vuurwapentechniek hebben ontwikkelt zonder een aanname van een bepaalde schietkracht van de geweren, heeft de wetenschap van de elektriciteit geen enkel excuus om een “elektrische scheidingskracht” aan te nemen die analoog is aan deze schietkracht, een kracht waarin absoluut geen energie verborgen is, en die daarom uit zichzelf niet een miljoenste van een milligram-millimeter werk kan verrichten.
Hetzelfde geldt voor de tweede vorm van deze “scheidingskracht”, de door Helmholtz genoemde “elektrische contactkracht van metalen”. Het is niets anders dan de eigenschap van metalen om energie van een andere vorm om te zetten in elektriciteit wanneer ze met elkaar in contact komen. Het is dus ook een kracht die geen vonkje energie bevat. Laten we met Wiedemann aannemen dat de energiebron van de contactelektriciteit in de levende kracht van de adhesie zit; dan bestaat deze energie allereerst in de vorm van beweging van een massa, en wanneer ze verdwijnt, verandert ze onmiddellijk in een elektrische beweging, zonder ook maar een moment de vorm van de “elektrische contactkracht” aan te nemen.
En nu zijn we er bovendien van overtuigd dat deze “elektrische scheidingskracht”, die niet alleen op zichzelf geen energie bevat, maar volgens het concept ervan ook helemaal geen energie kan bevatten, proportioneel gerelateerd is aan de elektromotorische kracht, d.w.z. de chemische energie die weer opduikt als een elektrische beweging! Deze verhouding tussen niet-energie en energie maakt duidelijk deel uit van de wiskunde waarin de verhouding van de eenheid elektriciteit ten opzichte van het milligram voorkomt. Maar achter de absurde vorm, dat zijn bestaan alleen dankt aan het concept van een eenvoudige eigenschap zoals een mystieke kracht, zit een zeer eenvoudige tautologie: het vermogen van een bepaalde keten om vrijgekomen chemische energie om te zetten in elektriciteit die wordt gemeten – door wat? Welnu, door de hoeveelheid energie die terugkomt als elektriciteit in de stroomkring, in verhouding tot de chemische energie die in de kolom wordt verbruikt. Dat is alles.
Om een elektrische scheidingskracht te hebben moet men het vervangend middel, de twee elektrische vloeistoffen, serieus nemen. Om ze uit hun neutraliteit te verplaatsen naar hun polariteit, om ze uit elkaar te halen, is een bepaalde hoeveelheid energie nodig – de elektrische scheidingskracht. Eenmaal van elkaar gescheiden, kunnen de twee elektronen dezelfde hoeveelheid energie vrijmaken wanneer ze worden herenigd – elektromotorische kracht. Maar omdat tegenwoordig niemand, zelfs Wiedemann niet, deze beide elektrische stromen als reëel beschouwt, kan men zeggen dat het voor een afwezig publiek is geschreven, zou men zich daar uitvoerig mee willen bezig houden.
De fundamentele fout van de contacttheorie is dat men niet kan afstappen van het idee dat contactkracht of elektrische scheidingskracht, een energiebron is, wat moeilijk te doen is als men de loutere eigenschap van een apparaat om energietransformatie te realiseren, had omgezet in een kracht; want een kracht wordt verondersteld een bepaalde vorm van energie te zijn. Omdat Wiedemann zich niet kan ontdoen van dit onduidelijke idee van kracht, hoewel moderne ideeën van onverwoestbare en onveranderbare energie zich aan hem hebben opgedrongen, vervalt hij in die zinloze verklaring van de elektriciteit nr. 1 en in alle latere bewezen tegenstrijdigheden.
Als de uitdrukking: elektrische scheidingskracht, direct absurd is, is de andere: elektromotorische kracht, op zijn minst overbodig. We hadden al warmtemotoren lang voordat we elektromotoren hadden, en de warmtetheorie is goed ontwikkeld zonder een speciale thermomotorische kracht. Net zoals de eenvoudige term warmte alle bewegingsverschijnselen omvat die bij deze vorm van energie behoren, zo kan ook de term elektriciteit in zijn vakgebied worden gebruikt. Bovendien zijn veel vormen van elektriciteit niet direct “motorisch”, zoals het magnetiseren van ijzer, chemische ontleding of het omzetten in warmte. En tenslotte, in elke natuurwetenschap, zelfs in de mechanica, is het elke keer als je ergens het woord kracht kwijt raakt, een vooruitgang.
We zagen dat Wiedemann de chemische verklaring van de processen in de kolom niet zonder enige terughoudendheid accepteerde. Deze terughoudendheid achtervolgt hem voortdurend; waar hij iets kan koppelen aan de zogenaamde chemische theorie, gebeurt dat zeker. Dus
“het is helemaal niet gefundeerd dat de elektromotorische kracht in verhouding staat tot de intensiteit van de chemische activiteit.” (I, p. 791)
Zeker niet in alle gevallen; maar waar deze proportionaliteit niet plaatsvindt, is dit slechts een bewijs dat de keten slecht geconstrueerd is, dat er energie wordt verspild. En daarom heeft dezelfde Wiedemann helemaal gelijk als hij in zijn theoretische deducties helemaal geen rekening houdt met zulke incidentele omstandigheden die de zuiverheid van het proces vervalsen, maar fijntjes beweert dat de elektromotorische kracht van een element gelijk is aan het mechanische equivalent van de chemische activiteit die plaatsvindt, in de tijdseenheid, in dezelfde eenheid van stroomsterkte. En op een andere plaats:
“Dat verder in de zuur-alkali keten de binding van het zuur en het alkali niet de oorzaak is van de stroomvorming, volgt uit de experimenten §§ 61” (Becquerel en Fechner), “§ 260” (Du Bois-Reymond) en “§ 261” (Worm-Müller), “volgens welke in bepaalde gevallen, wanneer deze in gelijke hoeveelheden worden aangetroffen, er geen elektriciteit wordt opgewekt, en ook uit de in § 62 genoemde experimenten” (Henrici), “dat de elektromotorische kracht op dezelfde manier optreedt wanneer een salpeteroplossing wordt ingebracht tussen de bijtende potasoplossing en salpeterzuur, als zonder deze.” (I, p. 791/792)
De vraag of de verbinding van zuur en alkali de oorzaak is van de stroomvorming is een zeer ernstige zaak voor onze auteur. In deze vorm is het heel gemakkelijk om te antwoorden. De binding van zuur en alkali is in de eerste plaats de oorzaak van de vorming van zout, door het vrijkomen van energie. Of deze energie geheel of gedeeltelijk de vorm van elektriciteit zal aannemen, hangt af van de omstandigheden waaronder het vrijkomt. In de keten: salpeterzuur en kaliumoplossing tussen bv. platina-elektroden zal dit op zijn minst gedeeltelijk het geval zijn, hoewel het voor de stroomvorming niet relevant is of een salpeteroplossing al dan niet tussen zuur en alkali wordt gebracht, omdat dit de vorming van zout hoogstens kan vertragen, maar niet voorkomen. Als echter een kolom zoals die van Worm-Müller wordt gemaakt, waar Wiedemann voortdurend naar verwijst, waar zich in het midden een zure en een alkalische oplossing bevindt, maar aan beide uiteinden een zoutoplossing, en in dezelfde concentratie als de oplossing in de kolom, kan er natuurlijk geen stroom worden gecreëerd, want door de eindschakels – aangezien overal identieke lichamen worden gevormd – kunnen er geen ionen worden gecreëerd. Zo is de omzetting van de vrijgekomen energie in elektriciteit onmiddellijk verhinderd als wanneer de kring niet was gesloten; men moet niet verbaasd zijn als men geen elektriciteit krijgt. Maar dat zuur en alkali algemeen gesproken een elektrische stroom kunnen produceren, wordt bewezen door de keten: steenkool, zwavelzuur (1 op 10 water), potas (1 op 10 water), steenkool, die volgens Raoult een stroomsterkte van 73[11] heeft; en dat, als de kolom goed is opgezet, een stroomsterkte kan leveren die overeenkomt met de grote hoeveelheid energie die vrijkomt als hij wordt aangesloten, omdat de sterkste bekende kolommen bijna uitsluitend gebaseerd zijn op de vorming van alkalizouten, bv. [Brug van] Wheatstone: platina, platinachloride, kaliumamalgaam, stroomsterkte 230; loodperoxide, verdund zwavelzuur, kaliumamalgaam = 326; mangaanperoxide in plaats van loodperoxide = 280, waarbij elke keer dat zinkamalgaam werd gebruikt in plaats van kaliumamalgaam, de stroomsterkte bijna precies met 100 daalde. Op dezelfde manier verkreeg Beetz in de keten: vast mangaandioxide, kaliumpermanganaatoplossing, kaliumhydroxideoplossing, kalium, stroomsterkte 302, verder: platina, verdund zwavelzuur, kalium = 293,8; Joule: platina, salpeterzuur, kaliumhydroxideoplossing, kaliumamalgaam = 302. De “oorzaak” van deze uitzonderlijke stroomsterkte is zeker de binding van zuur en alkali, oftewel alkalimetaal, en de grote hoeveelheid energie die daarbij vrijkomt.
En een paar pagina’s verder staat er weer:
“Er moet echter worden opgemerkt dat het arbeidsequivalent van de gehele chemische werking op het contactpunt van de heterogene lichamen niet rechtstreeks kan worden beschouwd als een maatstaf voor de elektromotorische kracht in een stroomkring. Als bv. in de zuur-alkali kolom van Becquerel” (iterum Crispinus) “deze twee stoffen zich in de kolom binden, als in de kolom: platina, gesmolten salpeter, kool, verbrande kool, wanneer in een gewoon element: koper, onzuiver zink, verdund zwavelzuur, het zink snel oplost met de vorming van lokale stromen, dan wordt een groot deel van de arbeid in deze chemische processen” (het moet zijn: vrijgekomen energie) “omgezet in warmte en gaat zo verloren voor het gehele circuit.” (I, p. 798)
Al deze processen zijn te wijten aan energieverlies in de kolom, ze hebben geen betrekking op het feit dat de elektrische beweging wordt opgewekt uit omgezette chemische energie, maar alleen op de hoeveelheid omgezette energie.
Elektriciens besteedden eindeloos veel tijd en moeite aan het samenstellen van de meest uiteenlopende ketens en het meten van hun “elektromotorische kracht”. Het op deze manier geaccumuleerde experimentele materiaal bevat veel waardevol materiaal, maar zeker veel meer waardeloos. Welke wetenschappelijke waarde hebben experimenten, bijvoorbeeld, waarbij “water” als elektrolyt wordt gebruikt, wat, zoals nu door F. Kohlrausch wordt bewezen, de slechtste geleider is, d.w.z. ook de slechtste elektrolyt,[12] waarbij het niet het water is maar onbekende onzuiverheden, dat het proces veroorzaakt? En toch is bijvoorbeeld bijna de helft van alle experimenten van Fechner gebaseerd op een dergelijk gebruik van water, zelfs zijn “experimentum crucis [beslissende proef]”, waarbij hij de contacttheorie onwankelbaar wilde funderen op de ruïnes van de chemische theorie. Zoals blijkt, zijn in bijna alle experimenten, op enkele na, de chemische processen in de keten, die de bron zijn van de zogenaamde elektromotorische kracht, zo goed als genegeerd. Er zijn echter een hele reeks ketens waarvan de chemische formulering ons niet in staat stelt om betrouwbare conclusies te trekken over de chemische omzettingen die erin plaatsvinden nadat het stroomkring is uitgeschakeld. Integendeel, zoals Wiedemann (I, p. 797) zegt [dat het]
“niet te ontkennen [is] dat we de chemische aantrekkingskracht in de ketens nog niet in alle gevallen doorzien”.
Al deze experimenten zijn dus waardeloos vanuit chemisch oogpunt, wat belangrijk is, totdat het proces gecontroleerd wordt herhaald.
Het is slechts bij uitzondering dat de omzettingen van energie in de ketens, nu experimenteel overwogen worden. Velen zijn gedaan voordat de wet van de equivalentie van beweging wetenschappelijk werd erkend, maar ze slepen zich gewoonlijk ongecontroleerd en onvoltooid van het ene naar het andere handboek. Als er wordt gezegd dat elektriciteit geen inertie heeft (wat ongeveer evenveel zin heeft als dat snelheid geen specifiek gewicht heeft), dan kan dit niet worden gezegd van de theorie van de elektriciteit.
Tot nu toe hebben we het galvanische element beschouwd als een mechanisme waarbij, als gevolg van de vastgestelde contactverhoudingen, chemische energie vrijkomt en wordt omgezet in elektriciteit op een manier die nog niet bekend is. We hebben de elektrolysecel ook beschreven als een apparaat waarin het omgekeerde proces in gang wordt gezet, de elektrische beweging wordt omgezet in chemische energie en als zodanig wordt verbruikt. We moesten ons richten op de chemische kant van het proces, die zeer werd verwaarloosd door de elektriciens, omdat dit de enige manier was om ons te ontdoen van de warboel van ideeën, overgeleverd uit de oude contacttheorie en de theorie van de twee elektrische vloeistoffen. Is dit gebeurd, is het de vraag of het chemische proces in de ketens onder dezelfde omstandigheden plaatsvindt als daarbuiten, of dat er speciale verschijnselen optreden die afhankelijk zijn van elektrische activering.
Onjuiste ideeën in elke wetenschap zijn immers, als we afzien van waarnemingsfouten, onjuiste ideeën van correcte feiten. De laatste blijven, zelfs als we bewijzen dat de eerste vals is. Als we de oude contacttheorie hebben afgeschud, zijn er nog steeds de vastgestelde feiten die als verklaring zouden moeten dienen. Laten we eens kijken naar deze feiten en dus naar de eigenlijke elektrische kant van het proces in de ketens.
Het wordt niet betwist dat het contact van heterogene lichamen met of zonder chemische veranderingen opwekking van elektriciteit veroorzaakt, wat kan worden aangetoond met behulp van een elektroscoop of een galvanometer. De energiebron van deze op zich uiterst minimale bewegingsverschijnselen is in individuele gevallen moeilijk vast te stellen, zoals we in het begin al zagen; het is voldoende dat het bestaan van zo’n externe bron over het algemeen wordt toegegeven.
Kohlrausch publiceerde in 1850-1853 over een reeks experimenten waarin hij de afzonderlijke onderdelen van een kolom paarsgewijs samenstelde en testte op de statisch-elektrische spanningen die telkens konden worden gedetecteerd; de algebraïsche som van deze spanningen moet dan worden gebruikt om de elektromotorische kracht van het element te berekenen. Dus, uitgaande van de spanning Zn/Cu = 100, berekent hij de relatieve sterkte van het Daniell- en het Grove-element als volgt:
Daniell:
Zn/Cu + amalgaam Zn/H4SO4 + Cu/SO4Cu = 100 + 149 – 21 = 228;
Grove:
Zn/Pt + amalgaam Zn/H2SO4 + P/HNO3 = 107 + 149 + 149 = 405,
wat nauw aansluit bij de directe meting van de stroomsterkte van deze elementen. Deze resultaten zijn echter geenszins zeker. Ten eerste, Wiedemann wijst er zelf op dat Kohlrausch slechts het eindresultaat geeft, maar
“helaas geen cijfers geeft voor de resultaten van de individuele experimenten.” [I, p. 104]
En ten tweede erkent Wiedemann zelf steeds weer dat alle pogingen om de elektrische spanningen te bepalen wanneer metalen en, meer nog, metalen en vloeistoffen met elkaar in contact komen, op zijn minst zeer onzeker zijn vanwege de talrijke onvermijdelijke fouten. Als hij desondanks meerdere malen de cijfers van Kohlrausch gebruikt in zijn berekeningen, is het beter om hem hierin niet te volgen, temeer er een ander bepalend middel is, waartegen deze bezwaren van geen tel zijn.
Als de twee geactiveerde platen van een kolom in de vloeistof worden neergelaten en vervolgens aangesloten op de uiteinden van een galvanometer om een stroomkring te vormen, dan is volgens Wiedemann
“het aanvankelijke uitslaan van de magnetische naald, voordat de chemische veranderingen de sterkte van de elektrische stroom hebben veranderd, een maat voor de som van de elektromotorische krachten in de stroomkring.” [I, p. 62]
Ketens met verschillende sterktes geven dus verschillende initiële afwijkingen, en de grootte van deze initiële afwijkingen, is evenredig met de stroomsterkte van de overeenkomstige ketens.
Het lijkt erop dat we hier duidelijk te maken hebben met de “elektrische scheidingskracht”, de “contactkracht”, die een beweging veroorzaakt die onafhankelijk is van chemische activiteit. Dit is wat de hele contacttheorie bedoelt. En inderdaad, hier hebben we een relatie tussen elektrische spanning en chemische activiteit die we hierboven nog niet hebben onderzocht. Laten we eerst de zogenaamde elektromotorische wet nader bekijken; we zullen zien dat ook hier de traditionele noties van contact niet alleen geen verklaring bieden, maar ook de weg naar een verklaring direct blokkeren.
Als men verdund zoutzuur, koper, een derde metaal, bv. een platinaplaat, in een element dat bestaat uit twee metalen en een vloeistof, bv. zink, plaatst zonder deze met een looddraad met een extern circuit te verbinden, is het aanvankelijke uitslaan van de galvanometer exact gelijk aan die zonder platinaplaat. Het heeft dus geen invloed op de opwekking van elektriciteit. Dit kan echter niet op zo’n eenvoudige manier in elektromotorische taal worden uitgedrukt. Er staat:
“De elektromotorische kracht van zink en koper in de vloeistof is nu vervangen door de som van de elektromotorische krachten van zink en platina en platina en koper. Aangezien het tracé van de elektriciteit niet merkbaar verandert door het inbrengen van de platinaplaat, kunnen we uit de gelijksoortigheid van de data van de galvanometer in beide gevallen concluderen dat de elektromotorische kracht van zink en koper in de vloeistof gelijk is aan die van zink en platina plus die van platina en koper in dezelfde vloeistof. Dit zou overeenkomen met Volta’s theorie van de spanning van de elektriciteit tussen de metalen op zich. Het resultaat, dat geldt voor elke vloeistof en elk metaal, wordt als volgt uitgedrukt: wanneer ze elektrisch geactiveerd worden door vloeistoffen, volgen de metalen de wet van de voltaïsche reeks. Deze wet wordt ook wel de elektromotorische wet genoemd.” Wiedemann, I, p. 62.
Als men zegt dat platina in deze combinatie helemaal geen elektriciteit opwekt, wordt een eenvoudig feit vermeld. Als we zeggen dat platina wel degelijk een elektriserende werking heeft, maar in twee tegengestelde richtingen van gelijke sterkte, zodat het effect teniet wordt gedaan, maken we van het feit een hypothese, alleen maar om de “elektromotorische kracht” de eer te geven. In beide gevallen speelt het platina de rol van stroman.
Op het moment van de eerste beweging van de meternaald is de stroomkring nog niet gesloten. Het zuur, niet ontbonden, geleidt niet; het kan alleen geleidend zijn door middel van ionen. Als het derde metaal niet reageert op de eerste beweging van de naald, dan is dat simpelweg omdat het nog steeds geïsoleerd is.
Hoe gedraagt het derde metaal zich nu na de productie van de continue stroom en tijdens zijn duur?
In de rij metalen in de meeste vloeistoffen ligt zink na de alkalimetalen vrij dicht bij het positieve uiteinde en het platina aan het negatieve uiteinde, en koper tussen de twee. Dus als platina tussen koper en zink wordt gezet zoals hierboven, is het negatief voor beide. De stroom in de vloeistof, als het platina al zou werken, zou van het zink en van het koper naar het platina moeten stromen, dat wil zeggen, weg van beide elektroden naar het niet-verbonden platina; wat een contradictio in adjecto is [tegenstrijdigheid in het bijgevoegde]. De basisvoorwaarde voor de effectiviteit van de verschillende metalen in de kolommen is dat ze met elkaar verbonden zijn om een stroomkring te vormen. Een niet aangesloten, overtollig metaal in de kolom is een niet-geleider; het kan geen ionen vormen of doorlaten, en zonder ionen kennen we geen geleiding in elektrolyten. Het is dus niet alleen een stroman, het staat zelfs in de weg en dwingt de ionen om er langs te gaan.
Hetzelfde geldt als we zink en platina verbinden en het koper ongebonden in het midden plaatsen: hier zou het, als het al werkte, een stroom van zink naar koper en een tweede stroom van koper naar platina creëren, zodat het als een soort tussen-elektrode moet fungeren en waterstofgas afzetten aan de zinkzijde, wat onmogelijk is.
Als we de traditionele elektromotorische wijze van spreken afschudden, is de zaak uiterst eenvoudig. De galvanische keten die we zagen, is een mechanisme waarbij chemische energie vrijkomt en wordt omgezet in elektriciteit. Het bestaat meestal uit een of meer vloeistoffen en twee metalen als elektroden, die buiten de vloeistoffen om geleidend met elkaar verbonden moeten zijn. Daarmee is het apparaat gemaakt. Wat we ook in de geactiveerde vloeistof onderdompelen zonder verbinding, of het nu metaal, glas, hars of wat dan ook is, kan niet meewerken aan het chemisch-elektrische proces, aan de vorming van stroom, zolang het de vloeistof niet chemisch verandert, hoogstens kan het het proces verstoren. Wat het elektrische vermogen van een derde, ondergedompeld metaal met betrekking tot de vloeistof en één of beide elektroden van de keten ook mag zijn, het kan geen effect hebben zolang dat metaal niet verbonden is met de stroomkring buiten de vloeistof.
Volgens dit alles is niet alleen de bovenstaande afleiding van de zogenaamde elektromotorische wet door Wiedemann fout; de betekenis die hij aan deze wet geeft is ook verkeerd. Evenmin kan men spreken van een compenserende elektromotorische activiteit van het ongebonden metaal, aangezien deze activiteit van meet af aan is afgesneden van de enige voorwaarde waaronder zij effectief kan worden; evenmin kan de zogenaamde elektromotorische wet worden afgeleid uit een feit dat buiten haar vakgebied valt.
In 1845 publiceerde de oude Poggendorff over een reeks experimenten waarin hij de elektromotorische kracht van verschillende ketens mat, d.w.z. de hoeveelheid elektriciteit die elke keten in een tijdseenheid levert. Van bijzondere waarde zijn de eerste 27, waarin drie specifieke metalen in dezelfde geactiveerde vloeistof, achtereenvolgens zijn verbonden om drie verschillende ketens te vormen, die vervolgens worden onderzocht en vergeleken wat betreft de hoeveelheid geleverde elektriciteit. Poggendorff plaatste als goede contact-elektrieker altijd het derde metaal los in de kolom en was tevreden om met eigen ogen te zien dat in alle 81 ketens deze “derde in het peloton” een stroman bleef. De betekenis ligt echter niet in deze experimenten, maar in de bevestiging en vaststelling van de juiste betekenis van de zogenaamde elektromotorische wet.
Laten we bij de bovenstaande rij ketens blijven, waarbij zink, koper en platina in verdund zoutzuur met elkaar verbonden zijn. Hier vond Poggendorff de hoeveelheden geleverde elektriciteit als volgt, waarbij het Daniëll-element = 100
| zink-koper | = | 78,8 |
| koper-platina | = | 74,3 |
| totaal | 153,1 | |
| zink-platina | = | 153,7 |
Zink in directe verbinding met platina leverde dus bijna exact dezelfde hoeveelheid elektriciteit als zink-koper + koper-platina. Hetzelfde gebeurde in alle andere ketens, ongeacht de gebruikte vloeistoffen en metalen. Als door middel van een reeks metalen die in dezelfde actieve vloeistof ondergedompeld worden, de ketens zo worden gevormd dat, volgens de voltaïsche reeks geldig voor deze vloeistof, het tweede, derde, vierde metaal, enz., na elkaar als negatieve elektrode met betrekking tot de vorige en als positieve elektrode met betrekking tot de volgende, dienen, dan is de som van de hoeveelheid elektriciteit die door al deze ketens worden geleverd, gelijk aan de hoeveelheid elektriciteit die door een kolom wordt geleverd die direct tussen de twee eindverbindingen van de volledige reeks metalen wordt gevormd. Zo zou bijvoorbeeld in verdund zoutzuur de totale hoeveelheid elektriciteit die wordt geleverd door de zink-tin, tin-ijzer, ijzer-koper, koper-zilver en zilver-platina schakeling, gelijk zijn aan de hoeveelheid geleverd door de zink-platina schakeling; een keten die wordt gevormd door alle elementen van de bovengenoemde reeks zou anders onder gelijke verhoudingen net geneutraliseerd worden door een zink-platina element, dat in de tegenovergestelde stroomrichting wordt ingeschakeld.
In deze versie krijgt de zogenaamde elektromotorische wet een reële en grote betekenis. Het onthult een nieuw aspect van de verbinding tussen chemische en elektrische activiteit. Tot nu toe, bij het onderzoek naar de energiebron van de galvanische stroom, bleek deze bron, de chemische reactie, de actieve kant van het proces te zijn; er werd elektriciteit uit opgewekt, dus in eerste instantie leek het passief te zijn. Nu is dit omgekeerd. De elektrische activiteit die wordt veroorzaakt door de aard van de heterogene lichamen die met elkaar in contact komen in de kolommen kan geen energie toevoegen of onttrekken aan de chemische werking (anders dan door het omzetten van vrijgekomen energie in elektriciteit). Maar het kan deze actie versnellen of vertragen, afhankelijk van de structuur van de kolom. Als de zinkverdunde zoutzuur-koper kolom in een tijdseenheid slechts half zoveel stroom levert als de zinkverdunde zoutzuur-platina kolom, betekent dit chemisch gezien dat de eerste kolom in een tijdseenheid slechts half zoveel zinkchloride en waterstof levert als de tweede. De chemische werking is dus verdubbeld, hoewel de zuiver chemische omstandigheden gelijk zijn gebleven. De elektrische activiteit is de regulator van de chemische werking geworden en verschijnt nu als de actieve kant, de chemische werking als het passieve.
Het wordt dus begrijpelijk dat een hele reeks processen die voorheen als puur chemisch werden beschouwd, nu elektrochemisch blijken te zijn. Chemisch zuiver zink wordt slechts zeer zwak aangetast door verdund zuur, als dat al het geval is; gewoon commercieel zink daarentegen lost snel op onder zoutvorming en waterstofontwikkeling, het bevat toevoegingen van andere metalen en koolstof, die op verschillende plaatsen aan het oppervlak ongelijk zijn vertegenwoordigd. Tussen hen en het zink zelf worden lokale stromen gevormd in het zuur, waarbij de zink-locaties de positieve elektroden vormen en de andere metalen de negatieve elektroden waar de waterstofbellen worden afgescheiden. Op dezelfde manier wordt het fenomeen van ijzer ondergedompeld in een koper-vitriooloplossing die bedekt is met een laagje koper nu beschouwd als elektrochemisch: het wordt veroorzaakt door stromen die ontstaan tussen de heterogene punten van het ijzeren oppervlak.
Zo vinden we ook dat de voltaïsche reeksen van metalen in vloeistoffen in hun geheel en voor een groot deel overeenkomen met de reeksen waarin de metalen elkaar met de halogenen en zure radicalen uit hun verbindingen verdringen. Aan het uiterste negatieve einde van de voltaïsche reeks vinden we regelmatig de metalen van de goudgroep: goud, platina, palladium, rhodium, die moeilijk te oxideren zijn, nauwelijks of niet worden aangetast door zuren en gemakkelijk uit hun zouten neerslaan door de andere metalen. Aan het uiterste positieve einde zijn er de alkalimetalen, die het tegenovergestelde gedrag vertonen: ze kunnen nauwelijks met het grootste energieverbruik van hun oxiden worden gescheiden, komen in de natuur bijna uitsluitend voor in de vorm van zouten en hebben van alle metalen veruit de grootste verhouding tot halogenen en zure radicalen. Tussen deze twee zijn er andere metalen in een enigszins wisselende volgorde, maar wel zodanig dat het elektrische en chemische gedrag correct is. De volgorde van de afzonderlijke vloeistoffen die eronder vallen, verandert afhankelijk van de vloeistoffen en is ook nauwelijks definitief bepaald voor een enkele vloeistof. Het is zelfs te betwijfelen of een dergelijke absolute voltaïsche reeks van metalen bestaat voor een enkele vloeistof. Twee stukken van hetzelfde metaal kunnen dienen als positieve en negatieve elektroden in geschikte ketens en elektrolysecellen, zodat hetzelfde metaal zowel positief als negatief kan zijn t.o.v. zichzelf. Bij thermo-elementen, die warmte omzetten in elektriciteit, verandert de stroomrichting bij grote temperatuurverschillen op de twee overgangen: het voorheen positieve metaal wordt negatief en omgekeerd. Evenzo is er geen absolute volgorde waarin metalen elkaar met een bepaalde halogeen of zuur-radicaal uit hun chemische verbindingen verdringen; door het leveren van energie in de vorm van warmte kunnen we in veel gevallen de reeks die van toepassing is op de gewone temperatuur bijna naar believen veranderen en omdraaien.
We vinden hier dus een eigenaardige wisselwerking tussen chemie en elektriciteit. De chemische werking in de kolom, die alle energie voor de vorming van elektriciteit levert, wordt op zijn beurt in veel gevallen eerst in gang gezet en in alle gevallen kwantitatief geregeld door de in de kolom geïntroduceerde elektrische spanningen. Als de processen in de kolom ons eerder chemisch-elektrisch leken, dan zien we hier dat ze net zo elektrochemisch zijn. Vanuit het oogpunt van de vorming van een continue stroom, verschijnt de chemische werking als primair; vanuit het oogpunt van activiteit van de stroom, verschijnt het als secundair, accessoir. De wisselwerking sluit elke absolute primaire en elke absolute secundaire factor uit, maar het is ook een tweezijdig proces dat uit de aard der zaak vanuit twee verschillende gezichtspunten kan worden beschouwd; om als geheel te worden begrepen moet het zelfs achtereenvolgens vanuit beide gezichtspunten worden bekeken voordat het totale resultaat kan worden samengevat. Als we echter eenzijdig het ene standpunt innemen als een absoluut standpunt tegenover het andere, of als we willekeurig van het ene naar het andere springen, afhankelijk van een kortstondige redeneerbehoefte, blijven we verstrikt in de eenzijdigheid van het metafysisch denken; de context ontsnapt ons en we raken verstrikt in de ene tegenstrijdigheid na de andere.
Hierboven zagen we volgens Wiedemann het aanvankelijke uitslaan van de galvanometer, direct na het onderdompelen van geactiveerde platen in de vloeistof van de kolom, en voordat chemische veranderingen de sterkte van de elektrische activiteit hebben veranderd,
“een maat is de som van de elektromotorische krachten in de stroomkring.”
Tot nu toe kenden we de zogenaamde elektromotorische kracht als een vorm van energie, die in ons geval werd opgewekt uit chemische energie in equivalente hoeveelheden en die in het verdere verloop weer werd omgezet in equivalente hoeveelheden warmte, beweging van een massa, enz. Hier leren we ineens dat de “som van de elektromotorische krachten in een stroomkring” al bestaat voordat chemische veranderingen die energie hebben vrijgemaakt; m.a.w., de elektromotorische kracht is niets anders dan het vermogen van een bepaalde kolom om een bepaalde hoeveelheid chemische energie in een tijdseenheid vrij te maken en om te zetten in elektrische beweging. Net als de elektrische scheidingskracht in het verleden verschijnt de elektromotorische kracht hier als een kracht die geen vonkje energie bevat. Wiedemann verstaat onder “elektromotorische kracht” dus twee totaal verschillende dingen: enerzijds het vermogen van een keten om een bepaalde hoeveelheid resulterende chemische energie vrij te maken en om te zetten in elektrische beweging, en anderzijds de ontwikkelde hoeveelheid elektrische beweging zelf. Het feit dat beide in verhouding staan tot elkaar, dat het ene een maat is voor het andere, doet het verschil niet teniet. De chemische werking in de kolom, de hoeveelheid ontwikkelde elektriciteit en de warmte die daardoor in de stroomkring wordt opgewekt, wanneer er geen ander werk wordt verricht, zijn meer dan evenredig, ze zijn zelfs gelijkwaardig; maar dit doet niets af aan hun verschil. De capaciteit van een stoommachine met een bepaalde cilinderdiameter en zuigerslag om een bepaalde hoeveelheid mechanische beweging te produceren uit de geleverde warmte is zeer verschillend van deze mechanische beweging zelf, hoe proportioneel deze ook is. En als zo’n manier van spreken aanvaardbaar was in een tijd dat er in de natuurwetenschap nog geen sprake was van behoud van energie, dan is het duidelijk dat met de erkenning van deze basiswet, echte levende energie, in welke vorm dan ook, niet verward mag worden met het vermogen van welk apparaat dan ook, om aan de vrijgekomen energie een vorm te geven. Deze verwarring is een gevolg van de verwarring van kracht en energie dankzij de elektrische scheidingskracht; in beide gevallen gaf het een harmonieuze achtergrond voor de drie totaal tegenstrijdige verklaringen van Wiedemann over de stroom, maar die uiteindelijk de basis was van al zijn fouten en warrigheid over de zogenaamde “elektromotorische kracht”.
Naast de reeds bekeken eigenaardige interactie tussen chemie en elektriciteit is er een tweede gemeenschappelijk kenmerk, dat ook wijst op een nauwe relatie tussen deze twee bewegingsvormen. Beide kunnen alleen maar verdwijnend bestaan. Het chemische proces vindt ineens plaats voor elke groep aanwezige atomen. Het kan maar verlengd worden door de aanwezigheid van nieuw verschijnend materiaal. Hetzelfde geldt voor de elektrische beweging. Niet eerder wordt het geproduceerd uit een andere bewegingsvorm, dan dat het weer overgaat in een derde bewegingsvorm; alleen een constante aanwezigheid van de beschikbare energie kan een constante stroom produceren, waarbij op elk moment nieuwe bewegingen de vorm van elektriciteit aannemen en weer verliezen.
Het inzicht in dit nauwe verband tussen chemische en elektrische werking en vice versa zal op beide onderzoeksgebieden tot grote resultaten leiden. Het wordt nu al steeds algemener. Onder de chemici verklaarden Lothar Meyer en na hem Kekulé, ronduit dat een hervatting van de elektrochemische theorie in een verjongde vorm op handen was. Zelfs onder elektriciens, zoals in het bijzonder de meest recente werken van F. Kohlrausch suggereren, lijkt de overtuiging te bestaan dat alleen een nauwkeurige observatie van de chemische processen in de kolom en de elektrolysecel hun wetenschap kan helpen om de impasse van oude tradities te doorbreken.
En inderdaad, het is onmogelijk om te zien hoe de doctrine van het galvanisme en, ten tweede, de doctrine van het magnetisme en statische elektriciteit een stevige basis kunnen krijgen, dan door een chemisch exacte algemene herziening van alle verouderde, ongecontroleerde experimenten. Op basis van een wetenschappelijk standpunt, met exacte observatie en bepaling van de energieomzettingen en met tijdelijke verwerping van alle traditionele theoretische ideeën over elektriciteit.
_______________
[7] Voor de feiten in dit hoofdstuk baseren we ons vooral op Wiedemanns Lehre vom Galvanismus und Elektromagnetismus, 2 vol. in 3 delen, 2e editie, Braunschweig [1872-]1874.
In Nature, 1882, 15 juni, wordt verwezen naar deze “bewonderenswaardige verhandeling die in haar aanstaande vorm, met toevoeging van de elektrostatica, de grootste bestaande experimentele verhandeling over elektriciteit zal zijn.”
[8] Ik gebruik de term “elektriciteit” in de zin van elektrische beweging met hetzelfde recht als de algemene term “warmte” wordt gebruikt om de vorm van beweging die zich aan onze zintuigen manifesteert als warmte uit te drukken. Dit kan des te minder bezwaarlijk zijn omdat elke mogelijke verwarring met de spanningstoestand van elektriciteit hier bij voorbaat uitdrukkelijk wordt uitgesloten.
[9] Onlangs heeft F. Kohlrausch (Wiedemanns Annalen, VI [Leipzig 1879], p. 206) berekend dat “immense krachten” betrokken zijn bij het verplaatsen van ionen in het oploswater. Om 1 mg een afstand van 1 mm te verplaatsen is een trekkracht nodig die voor H = 32.500 kg, voor Cl = 5.200 kg, d.w.z. voor HCl = 37.700 kg. – Zelfs als deze aantallen absoluut correct zijn, hebben ze geen invloed op het bovenstaande. De berekening bevat echter hypothetische factoren die tot nu toe onvermijdelijk waren op het gebied van elektriciteit en die daarom experimenteel moeten worden gecontroleerd. Dit lijkt mogelijk. Eerst moeten deze “immense krachten” weer opduiken op de plaats waar ze worden verbruikt, dat wil zeggen in de kolom in het bovenstaande geval, als een bepaalde hoeveelheid warmte. Ten tweede moet de energie die zij verbruiken lager zijn dan de energie die wordt geleverd door de chemische processen in de kolom, met een zeker verschil. Ten derde moet dit verschil in de rest van de stroomkring worden verbruikt en ook daar kwantitatief aantoonbaar zijn. Pas na bevestiging door deze controle kunnen bovenstaande cijfers definitief geldig zijn. De detectie in de elektrolysecel lijkt nog haalbaarder.
[10] Eens en voor altijd moet worden opgemerkt dat Wiedemann overal de oude chemische equivalenten gebruikt, waarbij hij HO, ZnCl enz. schrijft. In mijn vergelijkingen worden de moderne atoomgewichten overal gebruikt, d.w.z. H20, ZnCl2, enz.
[11] In alle volgende specificaties van de stroomsterkte is het Daniell-element: = 100.
[12] Een zuil met het zuiverste water, gepresenteerd door Kohlrausch, met een lengte van 1 mm bood dezelfde weerstand als een koperen kabel met dezelfde diameter en lengte van ongeveer de baan van de maan (Naumann, Allg. Chemie, p. 729).
{1} Engels: “Vervolgens wordt de negatieve elektriciteit in het zink verbonden met de positieve elektriciteit van het dichtstbijzijnde atoom Cl...”
{2} In de marge van het manuscript voegde Engels toe: “Als men aanneemt dat de huidige sterkte van één Daniëll-element = 100.”