MIA > Biblioteca > Engels > Novidades

Como o calor, apenas de outra maneira, a eletricidade possui também uma certa ubiquidade. Quase nenhuma transformação se pode dar, na terra, sem que se verifiquem fenômenos elétricos. Evapora-se a água, arde uma chama, entram em contato dois metais diferentes ou a diferentes temperaturas, ou então o ferro e o ácido sulfúrico diluído, etc.; com esses fenômenos físicos ou químicos mais evidentes, verificam-se, simultânea e paralelamente, processos elétricos. Quanto mais cuidadosamente investigamos os processos naturais, tanto mais encontramos vestígios de eletricidade. Mas apesar dessa ubiquidade que lhe é própria, apesar de que a eletricidade, desde há meio século, seja cada vez mais submetida ao serviço do homem, ela é precisamente a forma de movimento sobre cuja natureza reina a maior obscuridade. A descoberta da corrente galvânica é apenas 25 anos anterior à do oxigênio; e significa para o estudo da eletricidade, pelo menos, o mesmo que este para a química. E, no entanto, que diferença existe ainda entre esses dois domínios! Na química, graças principalmente à descoberta dos pesos atômicos, realizada por Dalton, existe ordem, relativa segurança quanto ao já conseguido, ataque sistemático ao terreno ainda não conquistado, uma ação semelhante ao sítio regular de uma fortaleza. No estudo da eletricidade impera uma confusa miscelânea de velhas experiências, idéias nem definitivamente confirmadas, nem definitivamente reprovadas, um inseguro tatear na obscuridade, um investigar e experimentar descoordenado, de muitos homens isolados, que atacam um território desconhecido, dispersamente, como um bando de cavalos selvagens. Mas é verdade que falta ainda, no domínio da eletricidade, realizar uma descoberta como a de Dalton, que forneça à ciência, em seu conjunto, um ponto central de apoio e à investigação uma base mais firme. É principalmente essa situação de abandono do estudo da eletricidade, o que torna impossível, nesse período, a delineação de uma teoria geral; situação que dá origem, nesse terreno, ao domínio do empirismo unilateral, esse empirismo que, tanto quanto possível, proíbe-se a si mesmo de pensar e que, justamente por isso, não só pensa falsamente, como também não se coloca em condições de acompanhar fielmente os fatos ou de informar fielmente sobre os mesmos; e que, portanto, se converte no contrário, do verdadeiro empirismo.
Se alguma leitura é recomendável a esses senhores investigadores, que não encontram palavras suficientes para classificar as extravagantes especulações apriorísticas da filosofia alemã da Natureza, é justamente uma leitura não só de autores da época, mas inclusive de obras físico-teóricas recentes da escola empírica, sobretudo no que se refere a investigação da eletricidade. Tomemos um trabalho do ano de 1840: An Outline of the Sciences of Heat and Electricity, de Thomas Thomson (1778-1852). O velho Thomson era, em seu tempo, uma autoridade e tinha, além disso, a sua disposição, uma parte muito importante dos trabalhos daquele que, até então, era o maior nome no terreno da eletricidade: Faraday. Apesar disso, seu livro contém extravagâncias pelo menos iguais as contidas na seção correspondente da Filosofia da Natureza, de Hegel, muito mais antiga. A descrição da faísca elétrica, por exemplo, poderia ter sido traduzida diretamente da respectiva passagem de Hegel. Ambos enumeram todas as curiosidades que se pretendiam descobrir na verdadeira natureza das faíscas e suas múltiplas diferenças, tendo-se verificado que quase todas elas eram resultado de erros ou constituíam casos especiais. Mas ainda há melhor. Thomson reproduz, na pág. 446, com toda a seriedade, as histórias fantásticas de Dessaignes (Victor, 1800-1885), segundo as quais, quando o barómetro sobe e o termómetro desce, o vidro, a resina, a seda, etc., submersos em mercúrio, se tornam eletronegativos; pelo contrário, ficam positivos quando o barómetro baixa e o termómetro sobe; que o ouro e outros metais, no verão, se tornam positivos ao serem aquecidos e negativos, quando esfriados; no inverno, o fenómeno é inverso; que, com pressão barométrica elevada e vento norte, se tornam fortemente eletropositivos quando a temperatura sobe e negativos quando desce. Isso, quanto ao modo de tratar os fatos. Mas, no que se refere à especulação apriorística, Thomson nos deleita com a seguinte interpretação da faísca elétrica, apoiada nada menos do que em Faraday:
"A faísca é uma descarga ou debilitação do estado de indução polarizada de muitas partículas dielétricas, mediante uma ação peculiar de algumas dessas partículas, que ocupam um espaço muito limitado. Faraday supõe que as poucas partículas em que se produz a descarga, não são apenas dispersadas, mas adquirem temporariamente um estado de extrema atividade (fortemente exaltadas); quer dizer que todas as forças que as rodeiam são precipitadas sobre elas que, por isso, são postas num estado de correspondente intensidade, talvez equivalente a dos átomos que se combinam; que, então, descarregam essas forças, tal como esses átomos as suas, de um modo até agora desconhecido, terminando tudo assim. O efeito final é exatamente o mesmo que se verificaria se uma partícula metálica tivesse sido posta no lugar dessa partícula produtora da descarga; e não parece impossível que os princípios de ação se mostrem os mesmos em ambos os casos".
E Thomson acrescenta: "Apresentei essa explicação de Faraday, com suas próprias palavras, porque não a compreendo claramente". Isso haverá ocorrido também a outras pessoas; e da mesma forma que ocorrerá se lerem em Hegel que, na faísca elétrica "a materialidade peculiar do corpo em tensão, não entrou ainda no processo, mas sim está determinada nele apenas elementar e animicamente"; e que a eletricidade é "a própria ira, o próprio levantamento indignado do corpo", seu "iracundo ele mesmo", que "aparece em todo o corpo, quando irritado" (Naturphil., § 324, acrescentado). Vê-se, pois, que o pensamento básico é o mesmo, quer em Hegel, que em Faraday. Ambos não querem admitir a concepção de que a eletricidade seja, não um estado da matéria, mas sim uma espécie própria da matéria. E, como na faísca, a eletricidade aparece como coisa independente, livre de todo o substrato material (isoladamente e, no entanto, perceptível aos sentidos), no estado em que se encontrava a ciência nessa época, sucumbem em face da necessidade de conceber a faísca como a forma aparente, em fase de desaparecimento, de uma força momentaneamente libertada de toda a matéria. Para nós, o enigma está resolvido desde que sabemos que, durante a descarga da faísca, saltam realmente partículas metálicas entre os eletródios metálicos e que, em consequência, "a materialidade peculiar ao corpo em tensão" na realidade, "entra no processo".
Como o calor e a luz, também a eletricidade e o magnetismo foram considerados, de início, como matérias especiais imponderáveis. No que respeita à eletricidade chegou-se, desde logo, a considerar duas matérias opostas, dois fluidos, um positivo e outro negativo, que, no estado normal, se neutralizam mutuamente, até que sejam separados por uma chamada força elétrica de separação. É possível, então, carregar dois corpos, um com eletricidade positiva e outro com eletricidade negativa; e quando os unimos com um terceiro corpo condutor, verifica-se a igualização, seja ela instantânea, ou por meio de uma corrente duradoura. A igualização instantânea parecia muito simples e ilustrativa; mas a corrente oferecia dificuldades. À hipótese mais simples (segundo a qual, na corrente elétrica se move em cada direção, somente eletricidade positiva ou somente eletricidade negativa) a essa hipótese opuseram Fechner mais detalhe, Weber a teoria de que, durante o fechamento do circuito, passam pelo fio, em direção contrária, duas correntes de eletricidade positiva e negativa, em canais, um ao lado do outro, situados entre as moléculas ponderáveis dos corpos(1). Traduzindo essa teoria por meio de extensa elaboração matemática, Weber chega a multiplicar uma função que não interessa ao caso por uma grande 1/r, que significa "a relação... da unidade de eletricidade com o miligrama" (Wiedemann, Lehre vom Galvanismu, etc., 2ª ed., III, pág. 569). A relação com uma medida de peso só pode ser, naturalmente, uma relação de peso. De sorte que, o empirismo unilateral, à força de tanto calcular, havia esquecido a tal ponto de pensar que transforma, neste caso, a eletricidade imponderável em um fator ponderável, introduzindo o seu peso no cálculo matemático.
As fórmulas deduzidas por Weber só eram aceitáveis dentro de certo limite; e Helmholtz, principalmente, por meio do cálculo, chegou a resultados que entram em conflito com a lei da conservação da energia. À hipótese de Weber, da dupla corrente em sentido contrário, opós C (are) Neumann (1832-1925), em 1871, uma outra: que somente uma das duas eletricidades, por exemplo a positiva, se move na corrente; e a outra, a negativa, permanece firmemente ligada à massa do corpo. A essa hipótese, apresenta Wiedemann a seguinte observação:
"Essa hipótese poderia ser acrescida à de Weber se, à dupla corrente por ele suposta, de massas elétricas ± 1/2 e, que fluem em sentido contrário, ajuntarmos outra corrente de eletricidade neutra, sem efeito exterior, que carregue consigo, na direção da corrente positiva, as quantidades de eletricidade iguais a ± 1/2 e (III, pág. 577).
Essa suposição é também típica do empirismo unilateral. Para conseguir que, de qualquer maneira, a eletricidade estabeleça corrente, é ela dissociada em positiva e negativa. Mas todas as tentativas para explicar a corrente por meio dessas duas espécies de matéria, se chocam com várias dificuldades: tanto a suposição de que apenas uma delas existe separadamente na corrente; como a de que ambas correm simultaneamente, em sentido contrário, uma ao lado da outra; e, finalmente, a terceira hipótese de que uma corre e a outra permanece em repouso. Se nos detivermos nessa última suposição, como explicar a inexplicável idéia de que a eletricidade negativa, que na máquina de eletrizar e na garrafa de Leyden é bastante movediça, permaneça imóvel, na corrente, e ligada à massa do corpo? Muito simplesmente. Além da corrente positiva +e que flui à direita do fio; e da negativa – e, que flui à esquerda, fazemos fluir à direita uma corrente neutra de eletricidade igual a ± 1/2 e. É necessário supor, primeiro, que as duas eletricidades, para que possam fluir, devem ser separadas uma da outra; e, para explicar os fenômenos que se produzem, ao fluírem as duas eletricidades separadas, admitimos que também podem fluir sem separar-se. Fazemos, primeiro, uma suposição para explicar determinado fenômeno; e, ao nos chocarmos com a primeira dificuldade, estabelecemos uma segunda suposição que elimina mansa e pacificamente a primeira. De que espécie será a filosofia da qual esses senhores têm o direito de queixar-se?
Ao lado dessa concepção que considera a eletricidade como coisa material, apareceu logo depois uma segunda, de acordo com a qual ela é um simples estado dos corpos, uma força, ou, como diríamos hoje, uma forma particular da movimento. Já tivemos ocasião de ver que tanto Hegel como Faraday, aceitam esse conceito. Depois que a descoberta do equivalente mecânico do calor pôs de lado, definitivamente, a idéia de uma substância calórica, considerando o calor como sendo um movimento molecular, o passo imediato seria encarar a eletricidade segundo a nova concepção e procurar determinar sua equivalência mecânica. Isso foi inteiramente conseguido. Principalmente em virtude das experiências de Joule, Favre e Raoult, não só se determinou a equivalência mecânica e térmica da chamada força eletromotriz da corrente galvânica, como também sua perfeita equivalência com relação à energia posta em liberdade por processos químicos, na célula excitante, ou consumida na célula de decomposição. Em face disso, a suposição de que a eletricidade é um fluido material especial se tornou cada vez mais insustentável.
No entanto, a analogia entre o calor e a eletricidade não era ainda completa. A corrente galvânica se apresentava sempre dois pontos muito importantes, de maneira diferente da condução de calor. Não se podia dizer ainda o que era que se movia nos corpos carregados de eletricidade. A suposição de uma simples vibração molecular, como no calor, parecia insuficiente. Com a imensa velocidade da eletricidade (maior ainda que a da luz). Tornava-se difícil passar ao longe sobre a idéia de que ali se movia qualquer coisa de material. Nesse ponto, interviram as novíssimas teorias de Clerk Maxwell (1864), Hankel (1865), Reynard (1870), apoiando unanimemente a hipótese estabelecida por Faraday, em 1846, de que a eletricidade seria um movimento produzido por um meio elástico que penetra todo o espaço e, consequentemente, todos os corpos, cujas partículas discretas se repelem entre si segundo a lei da razão inversa do quadrado da distância; em outras palavras: que é um movimento das partículas do éter, sendo que as moléculas dos corpos participam desse movimento. Quanto à natureza desse movimento discrepam as diferentes teorias (Wilhelm, 18141899) e Reynard (Paul Marie, n. 1805), apoiando-se nas novas investigações sobre os movimentos turbilionários, explicam-na de diferentes maneiras, de sorte que os torvelinhos do velho Descartes voltam a receber as honrarias em domínios sempre novos. Abstemo-nos de entrar em detalhes a respeito dessas teorias: diferem muito entre si e, por certo, sofrerão ainda grandes transformações. Mas, na sua concepção fundamental, parece ter havido um progresso decisivo: que a eletricidade de um movimento das partículas do éter luminoso que penetra toda a matéria ponderável e que reaciona sobre as moléculas dos corpos. Essa concepção concilia as duas precedentes. De acordo com ela, nos fenômenos elétricos se move, na realidade, algo de substancial, diferente da matéria ponderável. Mas essa substância não é a eletricidade propriamente dita, que, pelo contrário, através dos fatos se apresenta como uma forma de movimento, muito embora não seja como uma forma de movimento imediato, direto, da matéria ponderável. Enquanto que a teoria do éter aponta, por um lado, o caminho para se ir além da noção primitiva e torpe dos fluidos elétricos contrários, por outro lado oferece perspectivas para se esclarecer qual seja o verdadeiro substrato substancial do movimento elétrico; sobre o que vem a ser essa coisa cujo movimento provoca os fenómenos elétricos(2).
A teoria do éter teve já, pelo menos, um êxito decisivo. Quando mais não seja, existe um ponto em que a eletricidade altera o movimento da luz: desvia o seu plano de polarização. Clerk Maxwell, apoiado em sua já citada teoria, chegou à conclusão de que a constante dielétrica de um corpo é igual ao quadrado de seus índices de refração.Boltzmann calculou, então, a constante dielétrica de vários corpos não condutores, encontrando, para o enxofre, a resina e a parafina, um índice de refração igual à raiz quadrada desse coeficiente. A maior divergência — no enxofre — foi apenas de 4%. Dessa maneira, ficou confirmada, experimentalmente, num caso especial, a teoria de Maxwell a respeito do éter.
Muito tempo, no entanto, deverá transcorrer (e custará muito trabalho) até que novas séries de experiências venham destruir essas hipóteses (aliás, contraditórias entre si), até que se venha a estabelecer uma doutrina sólida. Até esse dia, ou até que a teoria do éter seja substituída por outra inteiramente nova, a investigação dos fenómenos elétricos se encontrará na desagradável situação de ser forçada a servir-se de expressões que sabemos, de antemão, que não são verdadeiras. Toda a sua terminologia se baseia ainda na idéia de que existem dois fluidos elétricos. Fala-se, ao mesmo tempo, com desembaraço, de massas elétricas que percorrem os corpos, de uma separação das duas eletricidades em cada molécula, etc. Esse é um mal que, como já disse, em grande parte é consequência inevitável do atual estado de transição da ciência; mas que é devido, também, ao empirismo unilateral, predominante nesse ramo da investigação científica e que, em não pequeno grau, contribui para manter a confusão mental reinante até agora.(II)
A oposição entre a chamada eletricidade estática (ou de fricção) e a eletricidade dinâmica (ou galvanismo) pode muito bem ser agora superada, desde o momento em que aprendemos a produzir correntes permanentes com a máquina de eletrizar; e, inversamente, produzir a chamada eletricidade estática por meio da corrente galvânica, carregar com ela garrafas de Leyden, etc. Deixamos, por enquanto, de tratar da subforma da eletricidade estática, como também do magnetismo, reconhecido agora como sendo igualmente outra subforma da eletricidade. A explicação teórica dos respectivos fenómenos terá que ser encontrada, seguramente, na teoria da corrente galvânica; e, por isso, nos deteremos principalmente nesta.
Uma corrente permanente pode ser produzida por diversos processos. O movimento mecânico de massa produz diretamente, por fricção, somente eletricidade estática, como primeiro efeito; mas uma corrente duradoura só pode ser obtida com um grande desperdício de energia. Para, poder ser convertido em movimento elétrico, pelo menos em grande parte, o movimento mecânico precisa do auxílio intermediário do magnetismo, tal como acontece nas conhecidas máquinas eletromagnéticas de: Gramme, Siemens, etc. O calor pode ser diretamente convertido em eletricidade, como se verifica no ponto de junção de dois metais diferentes. A energia posta em liberdade pela ação química (que, em condições ordinárias, é produzida sob a forma de calor) se transforma, sob determinadas condições, em movimento elétrico. Este último, desde que se verifiquem as condições para isso, passa a ser qualquer outra forma de movimento: movimento de massa, em pequena escala, diretamente, em virtude das atrações e repulsões eletrodinâmicas; em grande escala, novamente por intermédio do magnetismo, nas máquinas motrizes eletromagnéticas; em calor, em todas as partes, ao fechar-se o circuito de corrente, caso não se tenham colocado outras derivações; em energia química, nas células de decomposição e nos voltímetros que são intercalados no seu circuito, em que a corrente decompõe combinações que, de outro modo, são atacadas em vão.
Em todas essas conversões, prevalece a lei fundamental da equivalência quantitativa do movimento, em todas as suas transformações. Ou, como diz Wiedemann: "... segundo a lei da conservação da força, o trabalho produzido, por qualquer processo, a fim de gerar uma corrente elétrica, deve ser equivalente ao trabalho consumido para gerar todas as ações da corrente". Na conversão do movimento de massa ou do calor, em eletricidade, não se verificam dificuldades; está demonstrado que, no primeiro caso, a chamada força eletromotriz é igual ao trabalho executado naquele movimento;(3) no segundo caso é, "em cada ponto de contato da cadeia termoelétrica, diretamente proporcional à quantidade de calor medida em cada ponto de contato”. Verificou-se também, em todos esses fatos, a vigência da mesma lei no caso da eletricidade obtida por meio da energia química. Mas agora o assunto não se apresenta de maneira tão simplista; pelo menos no que diz respeito à teoria atualmente aceita.
Uma das mais belas séries experimentais sobre as mudanças de forma do movimento que se pode obter por meio de uma pilha galvânica é a de Favre (1857-1858). Pós ele em um calorímetro, uma pilha de 5 elementos; em um segundo calorímetro, uma pequena máquina motriz eletromagnética, com o eixo principal e polia de transmissão fora do aparelho, cada vez que, na pilha, era produzido 1 grama de hidrogênio com 32,6 gramas de zinco (o velho equivalente químico do zinco, sendo igual à metade do peso atómico de 65,2, hoje adotado e expresso em gramas) verificavam-se os seguintes resultados:
a) — Pilha no calorímetro, totalmente isolada, com exclusão da máquina motriz; produção de 18.682 a 18.674 calorias;
b) — Pilha e máquina conectada em circuito, mas sendo a máquina impedida de mover-se: calor, na pilha, 16.448; na máquina, 2.219; total, 18.667 calorias;
c) — Como em B, mas a máquina se move, sem levantar, no entanto nenhum peso; calor na pilha, 12.888; na máquina, 4.760; total, 18.657 calorias;
d) — Como em C, mas a máquina levanta um peso e, ao fazê-lo, realiza um trabalho mecânico = 131,24 quilogrâmetros. Calor na pilha, 14.427; na máquina, 2.947; total de 18.574 calorias. Perda em relação às anteriores 18.682 = 308 calorias. Mas o trabalho mecânico produzido, de 131,24 quilogrâmetros, multiplicado por 1.000 (para fornecer ao quilograma as gramas do resultado químico) dividido pelo equivalente mecânico do calor = 423,5 quilogrâmetros, dá em resultado 309 calorias, isto é, exatamente a perda assinalada como equivalente calórico do trabalho mecânico realizado.
A equivalência do movimento, em todas as suas transformações, ficou assim demonstrada também para o movimento elétrico, dentro dos limites das inevitáveis fontes de erro. E fica igualmente demonstrado que a força eletromotriz da cadeia galvânica, nada mais é do que energia química convertida em eletricidade; e a cadeia química nada mais é do que um dispositivo, um aparelho que transforma em eletricidade a energia química que vai sendo posta em liberdade; da mesma forma que uma máquina a vapor transforma em movimento mecânico o calor que lhe é fornecido, sem que, em nenhum desses casos, o aparelho transformador transfira de si mesmo qualquer outra energia.
Mas aqui aparece uma dificuldade em face ao modo tradicional de representar o processo. Esse modo de representá-lo, atribui à cadeia, em virtude das relações de contato nela estabelecida entre os líquidos e os metais, uma tensão elétrica de dissociação que é proporcional à força eletromotriz, representando, pois, para uma dada cadeia, uma determinada quantidade de energia. Como se comporta essa fonte de energia que, segundo o método tradicional de encarar as coisas, seria inerente à cadeia como tal (muito embora sem a ação química), no que diz respeito à energia posta em liberdade por essa ação? E, se for uma fonte de energia independente da ação química, donde procede a energia que produz?
Essa questão, sob uma forma mais ou menos obscura, constitui o ponto litigioso entre a teoria do contato, fundada por Volta, e a teoria química da corrente galvânica, que surgiu imediatamente depois.
A teoria do contato explicava a corrente como sendo resultado das tensões elétricas que se produziam na cadeia ao verificar-se o contato dos metais com um ou vários líquidos ou somente dos líquidos entre si; assim como estabelecendo-se a igualdade entre essas tensões elétricas, dissociadas em eletricidades opostas, ao fechar-se o circuito. As transformações químicas que acompanhavam esse processo eram consideradas inteiramente secundárias em face da teoria pura do contato. Contrariamente a isso, sustentava Ritter (Johann Wilhelm, 1776-1810), já em 1805, que uma corrente não pode ser estabelecida se os excitadores não atuarem quimicamente, uns sobre os outros, desde antes do fechamento do circuito. Essa antiga teoria química é resumida, em termos gerais, por Wiedemann (I, pág. 784) no sentido de que, de acordo com ela, a chamada eletricidade de contato “somente apareceria quando entra em atividade uma verdadeira ação química dos corpos em contato; ou pelo menos, uma perturbação do equilíbrio químico a qual, mesmo quando não esteja ligada diretamente a processos químicos, representa uma tendência à ação química".
Como se vê, a questão da fonte de energia, só indiretamente é debatida por ambas as partes, como aliás não podia deixar de ser nessa época. Volta e seus sucessores nada viam de extraordinário no fato de que o simples contato de corpos heterogêneos pudesse gerar uma corrente constante, ou seja, realizar uma determinada quantidade de trabalho sem receber nada em troca. Ditter e seus adeptos encontram-se igualmente às escuras quanto a saber a maneira pela qual a ação química põe a cadeia em condições de gerar a corrente e seu resultante rendimento de trabalho. Mas se, no que se refere à teoria química, esse ponto ficou esclarecido, faz algum tempo, por Joule, Favre, Raboult (François Marie, 1830-1901) e outros, com a teoria do contato sucede justamente o contrário. Na medida em que foi possível sustentar-se, permanece, quanto ao essencial, no seu ponto de partida. Idéias pertencentes a tempos superados desde muito, tempos em que era necessário nos contentarmos com o fato de atribuir a qualquer resultado obtido, a primeira causa aparente, que se pudesse encontrar à mão, muito embora das maneira se fizesse sair movimento do nada; idéias que contradizem frontalmente o princípio da conservação da energia continuam assim sobrevivendo independentemente, na atual teoria da elétricas. E, caso essas idéias sejam despojadas de seus aspectos mais chocantes, debilitadas, aguadas, castradas, embelezadas, isso em nada modifica a questão: a confusão se tornará cada vez maior.
Como tivemos ocasião de ver, a velha teoria química relativa à corrente declara que as relações de contato nos elementos da cadeia são estritamente necessárias para a formação da corrente; mas defende o ponto de vista de que esses contatos não conseguem jamais gerar uma corrente sem que se verifique uma ação química simultânea. E hoje, entretanto, se tornou evidente que os dispositivos de contato da cadeia constituem precisamente o aparelhamento mediante o qual a energia química posta em liberdade é convertida em corrente; e que depende essencialmente desses dispositivos de contato a quantidade de energia que se converterá em corrente.
Wiedemann, como empírico unilateral que é, procura salvar o que for possível da velha teoria do contato. Acompanhemo-lo em raciocínio:
"Se bem que o efeito do contato de corpos quimicamente indiferentes (diz Wiedemann, I, pág. 799), por exemplo, os metais, segundo se acreditava antes, nem é necessário à teoria da pilha, nem está demonstrado pela circunstância de haver Ohm deduzido sua lei baseado nessa, hipótese (porque essa lei pode ser deduzida mesmo sem essa teoria, e Fechner, que confirmou experimentalmente essa lei, também defendeu a teoria do contato), não se pode negar a excitação elétrica (sic) em virtude do contato de metais, pelo menos de acordo com as experiências atualmente realizadas, mesmo quando os resultados possíveis no que se refere à quantidade pudessem ter, nesse sentido, uma falha inevitável: a impossibilidade de manter absolutamente limpas as superfícies dos corpos em contato."
Vê-se, assim, que a teoria do contato se tornou muito modesta. Reconhece que não é de forma alguma necessária para explicar a corrente; e que não foi demonstrada, nem teoricamente por Ohm, nem experimentalmente por Fechner. Chega momento de reconhecer que as experiências denominadas fundamentais (as únicas em que, portanto, nos devemos apoiar) somente proporcionam resultados inseguros no sentido quantitativo; e pretende de nós, apenas isto: reconhecemos que, seja como for, a eletricidade pode ser produzida por contato, muito embora tão somente de metais!
Se a teoria do contato permanecesse apenas nisso, nada havia a lhe ser objetado. Que, em virtude do contato entre metais, ocorrem fenómenos elétricos por meio dos quais é possível fazer com que se contraiam os músculos de uma rã, carregar um eletroscópio e provocar outros movimentos, tudo isso se pode admitir incondicionalmente. Apenas devemos perguntar em seguida: mas donde procede a energia necessária para isso?
Para responder a essa pergunta (segundo Wiedemann, I, pág. 14),
“apresentaremos talvez as seguintes considerações: Se duas chapas metálicas heterogêneas A e B são aproximadas até uma pequena distância, elas se atraem em virtude das forças de adesão. Estabelecido o seu contato recíproco, perdem a força viva (4) do movimento, a qual lhes foi fornecida por essa atração. (Se admitirmos que as moléculas dos metais se encontram em permanente vibração, devemos levar em conta o seguinte: quando, por meio do contato desses metais heterogêneos, tocam-se as suas moléculas que vibram desigualmente, poderia também produzir-se uma mudança nas suas vibrações, com perda de força viva.) A força viva perdida converte-se, na sua maior parte, em calor. Uma pequena parte é utilizada para distribuir de modo diferente as eletricidades que ante não estavam separadas. Como dissemos acima, os corpos postos em contato se carregam com partes iguais de eletricidade positiva e negativa, talvez em consequência de uma atração desigual em relação a ambas essas formas de eletricidade".
A modéstia da teoria do contato se vai tornando cada vez maior. Primeiro se reconhece que a poderosa força de separação elétrica (que depois tem que realizar um trabalho gigantesco) não possui em si nenhuma energia própria e não pode entrar em ação enquanto não lhe for fornecida energia de alguma parte estranha a ela. E, em seguida, lhe é atribuída uma fonte de energia quase insignificante — a força viva de adesão — que só entra em atividade a distâncias dificilmente mensuráveis por tão pequenas que são e que faz os corpos percorrerem um caminho quase imperceptível. Mas isso pouco importa: ela existe inegavelmente e, sem dúvida, desaparecer depois do contato. No entanto, mesmo essa fonte mínima, fornece energia demasiada para os nossos fins: uma grande parte é convertida em calor e somente uma pequena parte é destinada a dar vida à força de separação elétrica. Mesmo sendo sabido que, na Natureza, ocorrem muitos casos em que impulsos extremamente pequenos provocam efeitos de extraordinária potência, o próprio Wiedemann parece sentir que essa fonte de energia quase gotejante dificilmente poderá produzir alguma coisa e procura descobrir uma possível segunda fonte, estabelecendo a suposição de uma interferência das vibrações moleculares de ambos os metais sobre as superfícies de contato. Além de outras dificuldades que se apresentam neste caso, Grove e Gassiot assinalaram que nem ao menos é necessário um perfeito contato para que se verifique a produção de eletricidade, conforme o próprio Wiedemann nos relata uma página antes. Em síntese: a fonte de energia da força de separação elétrica vai secando à medida que a examinamos.
E, no entanto, não conhecemos outra melhor para produção de eletricidade por intermédio do contato de metais. Segundo Naumann (Alexander, 1837-1922, Allgem. u. Phys. Chemie, Heidelberg, 1877, pág. 675), "as forças eletromotrizes de contato, transformam calor em eletricidade". Acha ele "natural a suposição de que a capacidade dessas forças disponível ou, em outras palavras, é uma função da temperatura", calor disponível ou, em outras palavras, é uma função da temperatura", o que estaria também demonstrado experimentalmente por Le Roux. Neste caso também, caminhamos dentro de uma total imprecisão. A lei da série de tensões dos metais proíbe que nos baseemos nos processos químicos que se sucedem incessantemente nas superfícies de contato dos metais, sempre cobertas por uma camada delgada (que a nós outros é praticamente impossível eliminar) de ar e água impura; isto é, pretender explicar a produção de eletricidade devido à presença de um eletrólito ativo invariável, entre as superfícies em contato. Um eletrólito dessa espécie teria que produzir, no circuito fechado, uma corrente constante; mas, pelo contrário, a eletricidade produzida por contato metálico simples desaparece quando se fecha o circuito. E assim chegamos ao ponto crucial da questão: sabermos se e de que maneira essa força de separação elétrica, antecipadamente limitada pelo próprio Wiedemann aos metais (declarada incapaz de produzir trabalho sem o abastecimento de energia externa e, em seguida, obrigada a recebê-lo de uma fonte de energia realmente microscópica), torna possível o surgimento da corrente elétrica duradoura por meio de contato de corpos quimicamente diferentes.
A série de tensões estabelece, entre os metais, uma determinada tensão elétrica. Mas, se colocarmos essa série de metais em um circuito de maneira que o zinco e a platina se toquem também, a tensão imediatamente se iguala e desaparece. "Em um circuito fechado, de corpos que pertencem à série de tensões, é portanto impossível a formação de uma corrente duradoura". Esse princípio é apoiado por Wiedemann, com as seguintes considerações teóricas:
"Na realidade, caso surgisse uma corrente elétrica no circuito, deveria produzir-se calor nos próprios condutores metálicos, o qual só poderia ser anulado por meio do esfriamento dos pontos de contato dos metais. Em todo o caso, se verificaria uma distribuição desigual de calor; poderia também ser movida uma máquina motriz eletromagnética sem nenhuma contribuição exterior, realizando-se assim um trabalho, o que é impossível, considerando-se que, se estabelecêssemos uma união fixa entre os metais, por exemplo, por meio de uma solda, já não seria possível haver mudanças de nenhuma espécie, nos pontos de contato, capazes de compensarem esse trabalho".
E não é bastante a prova teórica e experimental de que a eletricidade de contato entre os metais não pode, por si só, gerar uma corrente: veremos também que Wiedemann foi obrigado a estabelecer uma hipótese especial, visando eliminar sua ação, mesmo nos casos em que poderia prevalecer, de certo modo, na corrente.
Procuremos então outro caminho para chegarmos à corrente elétrica por meio da eletricidade de contato. Imaginemos, como Wiedemann,
"dois metais: uma barra de zinco e outra de cobre, soldadas em uma de suas faces, mas tendo suas faces livres unidas por um terceiro; corpo que não atue eletricamente sobre elas, mas que apenas conduza as duas eletricidades opostas, acumuladas em suas superfície, de modo que se tornassem iguais nesse mesmo corpo; dessa maneira, a força elétrica de separação restabeleceria constantemente a diferença de tensões e apareceria assim uma corrente elétrica contínua, no circuito, a qual, sem nenhuma contribuição externa, poderia realizar trabalho; o que é, por sua vez, impossível. Em consequência, não pode haver nenhum corpo que conduza somente a eletricidade, sem uma atividade eletromotriz contrária aos outros corpos".
Tudo isso de nada nos adiantou: a impossibilidade de criar movimento nos obstrui o caminho novamente. Por meio do contato de corpos quimicamente indiferentes, ou seja, por meio da eletricidade de contato propriamente dita, não conseguiremos, jamais uma corrente. Façamos, pois, de novo, meia volta e tentemos um terceiro caminho que nos aponta Wiedemann.
"Façamos submergir, finalmente, uma barra de zinco e outra de cobre em um líquido que contenha uma dessas combinações chamadas binárias, isto é, que se podem decompor em duas parte quimicamente diferentes, saturando-se completamente; por exemplo: ácido clorídrico diluído (Cl + H) etc. Assim sendo, o zinco fica carregado negativamente e o cobre positivamente, de acordo com o § 27. Ao se unirem os metais, essas eletricidades se tornam iguais no local de contato, pelo qual passa assim uma corrente de eletricidade positiva, indo do cobre para o zinco. Como também a força elétrica de separação (que aparece devido ao contato desses metais) conduz a corrente de eletricidade positiva no mesmo sentido, os efeitos da força elétrica de separação não se anulam, tal como acontece no circuito metálico fechado. Dessa forma, é produzida uma corrente contínua de eletricidade positiva que, no circuito fechado, passa do cobre para o zinco por seu local de contato; e, através do líquido, do zinco para o cobre. Dentro em pouco voltaremos ao seguinte ponto (§ § 34 e segs.): em que medida participam efetivamente, na formação dessa corrente, as forças de separação elétrica existentes no local de contato. Denominamos a essa combinação de condutores, que produz essa corrente galvânica, um elemento galvânico e também uma cadeia galvânica". (I, pág. 45).
Dessa maneira, se havia realizado o milagre. Apenas por meio da força de separação elétrica de contato que, segundo o próprio Wiedemann, não pode entrar em ação sem o fornecimento de energia exterior, foi gerada uma corrente contínua. E, se não nos fora oferecido, para sua explicação, outro argumento senão a citada passagem de Wiedemann, estaríamos realmente diante de um milagre. Neste caso, que aprendemos nós a respeito do processo em questão?
1) — Se submergirmos zinco e cobre em um líquido que contenha uma combinação denominada binária, o zinco se carrega negativamente e o cobre positivamente, de acordo com o § 27. Mas, em todo esse parágrafo, não há uma só palavra referente a essa combinação binária. Limita-se ele a descrever um elemento simples da pilha de Volta, que consta de uma chapa de zinco e outra de cobre, entre as quais se interpõe um disco de pano umedecido em um ácido e passa logo a determinar, sem mencionar nenhum processo químico, as cargas eletrostáticas que são, assim, produzidas em ambos os metais. Dessa maneira, a pretendida combinação binária é contrabandeada pela porta dos fundos.
2) — Qual o papel desempenhado, no caso, por essa combinação binária, é coisa que permanece no mais absoluto mistério. A circunstância de que "se podem decompor em dois elementos químicos que se saturam completamente" (saturam-se completamente depois de se haverem dissociado?!) poderia, quanto muito, ensinar-nos alguma coisa de novo se, de fato, se dissociassem. Mas, a esse respeito, não se diz uma só palavra; e em vista disso, devemos admitir, pelo menos por enquanto, que não se dissociam, como por exemplo, no caso da parafina.
3) — Depois que, no líquido, o zinco se tenha carregado negativamente e o cobre positivamente, devemos pó-los em contato (fora do líquido). Em seguida, "essas eletricidades se igualam totalmente, no local de contato, através do qual passam assim uma corrente de eletricidade positiva do cobre para o zinco". Neste caso, também não ficamos sabendo a razão pela qual passa uma corrente de eletricidade positiva, em uma direção, e não uma de eletricidade negativa, em direção contrária. Tampouco nos é dito o que foi feito da eletricidade negativa, apesar de que, até esse momento, ser ela tão necessária quanto a positiva. A ação da força de separação elétrica consistia, precisamente, em pôr em liberdade ambas as eletricidades, uma contra a outra. Agora é suprimida de repente, até certo ponto oculta, admitindo-se a possibilidade de que só existia eletricidade positiva.
Mas logo em seguida, na pág. 51, se diz exatamente o contrário, porque então "as eletricidades se unem, formando uma corrente", de modo que, neste caso, tanto passa a positiva como a negativa! Quem nos poderá tirar desse atoleiro
4) — "Como a força de separação elétrica que aparece, mediante o contato dos metais citados, conduz a eletricidade positiva em um mesmo sentido, os efeitos das forças de separação elétrica não se anulam, tal como acontece num circuito metálico fechado. Aparece, portanto, uma corrente contínua etc. Isso é um pouco forte. Porque, como podemos ver algumas páginas adiante (pág. 52), nos adverte Wiedemann de que “na formação da corrente contínua... a força de separação elétrica... deve permanecer inativa no local de contato dos metais"; que essa corrente é produzida não somente quando essa força, em vez de impulsionar a corrente em seu mesmo sentido, atua contra ela; mas tampouco nesse caso a corrente é compensada por determinar participação da força de separação elétrica da cadeia; e dessa forma, também nesse caso a referida força permanece inativa. Como pode Wiedemann, então, na pág. 45, fazer com que participe, como fator necessário na formação da corrente, uma força de separação elétrica que, já na pág. 52, põe fora de atividade durante toda a duração da corrente e, ainda mais, baseado numa hipótese especialmente estabelecida com esse fim?)
5) — "Produz-se, assim, uma corrente contínua de eletricidade positiva, que passa, no circuito fechado, do cobre para o zinco através do líquido". Mas, em consequência de tal corrente contínua, deveria originar-se “calor nos corpos condutores"; poderia também "ser movida uma máquina motriz eletromagnética e, assim, ser realizado um trabalho", o que é impossível sem um suprimento de energia. Como Wiedemann não nos revela, com uma palavra sequer, se e donde provém esse suprimento de energia, essa corrente contínua é também, neste caso, uma coisa tão impossível como os outros dois por ele analisados.
E isso não é sentido por ninguém melhor do que por Wiedemann. Tanto que ele considera conveniente passar tão rapidamente quanto possível sobre os muitos pontos controvertidos dessa curiosa e surpreendente maneira de explicar a produção de uma corrente elétrica; e, por outro lado, procura entreter o leitor, ao longo de várias páginas, com toda uma série de historietas elementares a respeito dos efeitos térmicos, químicos, magnéticos e fisiológicos dessa sempre misteriosa corrente, adotando, para isso, excepcionalmente, um tom bastante popular. E, logo depois, retoma o assunto novamente (pág. 49):
"Devemos agora investigar de que maneira atuam as forças de separação elétrica, em um circuito fechado composto de dois metais e um líquido, por exemplo, zinco, cobre e ácido clorídrico. Sabemos que os componentes da composição binária (H Cl), contida no recipiente cheio de água, separam-se ao passar a corrente; de maneira que um deles (H), é posto em liberdade no cobre e o outro, (Cl), no zinco; e, por esse motivo, o último se combina com uma quantidade equivalente de zinco, dando em resultado Zn Cl".
Sabemos. Se soubéssemos disso, não seria seguramente por intermédio de Wiedemann, que até este momento não nos revelou absolutamente nada a respeito desse processo, segundo temos visto. E, além do mais, se alguma coisa sabemos a esse respeito, é justamente que o fenómeno não se pode realizar da maneira descrita por Wiedemann.
Ao formar-se uma molécula de ácido clorídrico, constituída de hidrogênio e cloro, é posta em liberdade uma quantidade de energia = a 32.000 calorias (Julius Thomsen, 1826-1909). De sorte que, para subtrair o cloro dessa combinação com o hidrogênio, seria necessário substituir cada molécula de H Cl, por essa mesma quantidade de energia. E donde tira a cadeia essa energia? A explicação de Wiedemann nada esclarece. Busquemo-la, pois, nós mesmos.
Quando o cloro se combina com o zinco, formando cloreto de zinco, é posta em liberdade uma quantidade muito maior de energia do que a necessária para separar o cloro do hidrogênio (Zn, Cl2) desenvolve, 97.210, 2 (H, Cl) calorias (Julius Thomsen). E assim se torna compreensível o processo que se verifica na cadeia. De sorte que o hidrogênio, em contato com o cobre, não é posto em liberdade sem mais nem menos; nem o cloro com o zinco se combinam casualmente. Pelo contrário: a combinação do zinco com o cloro é a condição fundamental de todo o processo; e, enquanto não se produzir, esperaremos em vão o aparecimento do hidrogênio do lado do cobre.
As sobras da energia posta em liberdade ao tornar-se a molécula de Zn Cl2, relativamente à consumida para desprender dois átomos de H de duas moléculas de H Cl, convertem-se, na cadeia, em corrente elétrica, provendo toda a força eletromotriz que aparece no circuito de corrente. Não é, portanto, nenhuma misteriosa força de separação elétrica que extrai o cloro do hidrogênio, sem a indicação, até este momento, de nenhuma fonte de energia; é o processo químico total, que se desenvolve na cadeia, o responsável pelo provimento da energia necessária a todas as forças de separação elétrica e forças eletromotrizes.
Assinalemos, por enquanto, que a segunda explicação de Wiedemann, tal como a primeira, não nos tirou do pântano; e continuemos examinando o seu texto.
"Este processo demonstra que a conduta do corpo binário, entre os dois metais, já não consiste somente em uma simples atração predominante, de toda a sua massa, como acontece entre os metais, mas sim que há o acréscimo de uma ação especial de seus componentes. Considerando que o componente Cl se desprende no local em que a corrente de eletricidade positiva penetra no líquido; e o componente H, onde penetra a eletricidade negativa, admitamos que cada equivalente, do cloro, na combinação H Cl, esteja carregado de uma determinada quantidade de eletricidade negativa, o que determina sua atração pela eletricidade positiva. É esse o componente eletronegativo da combinação. Da mesma forma, o equivalente H deve estar carregado de eletricidade positiva, representando assim o componente eletropositivo da mesma combinação. Essas cargas poderiam ser produzidas pela combinação de H e Cl, da mesma forma que pelo contato entre o zinco e o cobre. Como a combinação H Cl é, em si, eletricamente neutra, devemos admitir, em consequência, que na mesma os átomos do componente positivo e do negativo contêm iguais quantidades de eletricidade positiva e negativa.
Se submergirmos uma chapa de zinco e uma outra de cobre em ácido clorídrico diluído, podemos então supor que o zinco manifesta uma atração mais forte pelo componente eletronegativo (Cl) do que pelo eletropositivo (H). Em consequência disso, as moléculas de ácido clorídrico, que entraram em contato com o zinco, se colocariam de modo a dirigir seus componentes eletropositivos para o zinco e os eletronegativos, para o cobre. Os componentes assim ordenados, atuam, por sua força de atração elétrica, sobre os componentes assim ordenados, atuam, por sua força de atração elétrica, sobre os componentes da molécula de H Cl seguinte; e toda a fila de moléculas entre a chapa de zinco e a de cobre, fica ordenada como se vê na figura 10:
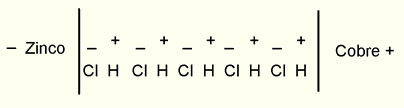
"Se o segundo metal atuasse sobre o hidrogênio positivo, como o zinco sobre o cloro negativo, a ordenação seria favorecida. Caso atue em sentido contrário, porém mais debilmente, permanece sem alteração a orientação daquelas”.
Em virtude da ação de influência da eletricidade negativa, do componente eletronegativo Cl, encostado ao zinco, a eletricidade do zinco ficaria distribuída de tal forma que as partes do mesmo mais próximas de Cl (da molécula também mais próxima de ácido), se carregariam positivamente; e as mais afastadas, negativamente. Da mesma forma, no cobre, na parte mais próxima do componente eletropositivo (H), da molécula de ácido clorídrico encostada, se acumularia eletricidade negativa; e a positiva seria impelida para as partes mais afastadas.
Então, a eletricidade positiva do zinco se combinaria com a negativa do átomo mais próximo Cl; e este, por sua vez, com o zinco de ZnCl2 neutro. O átomo eletro positivo H, que estava combinado com aquele átomo Cl, se combinaria com o átomo Cl (dirigido para ele) da segunda molécula de H Cl, verificando-se a simultânea combinação das eletricidades contidas em seus átomos de igual maneira se combinariam o H da segunda molécula de H Cl com o Cl da terceira molécula; e assim sucessivamente, até que, ao atingir o cobre, ficaria livre um átomo de H, cuja eletricidade positiva se combinaria com a negativa do cobre e, desse modo, se escaparia em um estado elétrico". Esse processo "se repetiria até que a repulsão das eletricidades acumuladas (resultantes dos componentes do ácido clorídrico a, elas dirigidos) entrasse em perfeito equilíbrio com a atração química dos últimos pelos metais. Mas, se as chapas metálicas são unidas entre si por um condutor, as eletricidades livres das chapas metálicas unem-se entre si e podem recomeçar os processos antes enunciados. Dessa maneira, se produziria uma corrente elétrica contínua. É fácil compreender que, durante o processo, se verifica uma perda constante de força viva, quando se dirigem para os metais, com uma certa velocidade, os componentes da combinação binária e entrem, então, em repouso, quer formando uma combinação (Zn Cl2), quer sendo postos em liberdade (H). [Observação (de Wiedemann): Considerando-se que aquisição de força viva, quando os componentes Cl e H se separam... é compensada pela força viva perdida na união dos mesmos com os componentes das moléculas mais próximas, a influência desse processo pode ser desprezada]. Essa perda de força viva, é equivalente à quantidade de calor posta em liberdade durante o processo químico que se torna visível, ou seja, no essencial, pela dissolução de uma equivalência de zinco no ácido diluído. O trabalho dependido na separação das eletricidades deve ser equivalente a esse valor. De sorte que, se as eletricidades se unem em uma corrente, então, durante a dissolução de um equivalente de zinco e o desprendimento de um equivalente de hidrogênio da massa líquida, deve produzir-se um certo trabalho em todo o circuito, quer sob a forma de calor, quer sob a forma de realização de trabalho externo, o qual é também equivalente ao desenvolvimento de calor correspondente àquele trabalho químico".
"Admitamos... poderiam... devemos admitir... podemos supor... se distribuiria... se carregariam..." etc., etc. Apenas conjeturas e condicionais, dentre as quais só podemos aceitar, com segurança, três considerações: primeiro, que a combinação do zinco com o cloro é agora mencionada como condição do desprendimento de hidrogênio; segundo (como o aprendemos, finalmente, e como que de passagem), que a energia posta em liberdade, por meio desse processo químico, é a fonte (e a fonte exclusiva) de toda a energia necessária à formação da corrente; e, em terceiro lugar, que essa explicação a respeito da formação da corrente é apresentada confusamente, sendo tão semelhante às duas outras como as mesmas entre si.
Logo depois diz ele:
“Por conseguinte, a força de separação elétrica pode ser única e, exclusivamente aquela que atua na produção da corrente, força essa que é proveniente da desigual atração e da polarização dos átomos da combinação binária, no líquido excitante da cadeia, por meio dos eletródios metálicos. Mas, a força de separação elétrica, no local de contato dos metais, com que já não podem ser produzidas transformações mecânicas, deve permanecer, pelo contrário, inativa. Que esta (quando, por exemplo, atua em sentido contrário à excitação eletromotriz dos metais pelo líquido, como acontece quando submergimos estanho e chumbo em uma solução de cianureto de potássio) não é compensada por determinada participação da força de separação nos últimos, fica provado pela citada proporcionalidade perfeita de toda a força de separação (e força eletromotriz) no circuito de fechamento, com a citada equivalência calórica dos processos químicos. Deve, pois, ser neutralizada de outra maneira. Isso sucederia do modo mais simples possível se supusermos que, durante o contato do líquido excitante com os metais, a força motriz é produzida duma dupla maneira: em primeiro lugar, devido a uma atração desigual das massas do líquido, considerado como um todo, por uma ou outra eletricidade; e depois, pela atração desigual dos metais pelos componentes do líquido, carregados de eletricidades contrárias... Em consequência da primeira atração desigual (de massas) pelas eletricidades, os líquidos se comportariam inteiramente de acordo com a lei da série de tensões dos metais; e num circuito fechado, se produziria uma completa neutralização das forças de separação elétrica (e as forças eletromotrizes); a segunda ação (química)... provocaria por si só a força de separação elétrica necessária para a formação de corrente e da força eletromotriz correspondente a ela". (I, págs. 52-53).
Com isso, o que restava da teoria do contato ficaria sem efeito — e a salvo — no que se refere à formação de corrente; e também o que resta da primeira explicação de Wiedemann a respeito da formação de corrente exposta na pág. 45. Finalmente, é reconhecido, sem reserva, que a cadeia galvânica não é mais do que um aparelhamento para converter a energia química, à medida que se vai pondo em liberdade, em movimento elétrico, nas chamadas forças de separação elétrica e força , eletromotriz; da mesma forma que a máquina a vapor é um aparelhamento destinado à conversão de energia calorífica em movimento mecânico. Tanto num como no outro caso, esse aparelhamento cria apenas (as condições para a libertação e as posteriores transformações da energia; mas, por si só, não produz energia. Uma vez esclarecido esse ponto, resta-nos ainda examinar mais de perto a terceira versão com que Wiedemann tenta explicar a corrente elétrica.
De que maneira explica ele as transformações da energia no circuito fechado da cadeia?
Diz ele ser compreensível o fato de que, na cadeia:
"tenha lugar uma perda constante de força viva ao serem atraídos pelos metais, com certa velocidade, os componentes da combinação binária e chegarem, então, ao repouso, quer formando uma combinação (Zn Cl2), quer se pondo em liberdade (H).
"Essa perda de força viva é equivalente à quantidade de calor posta em liberdade durante o processo químico que se torna visível, ou seja, no essencial, devido à dissolução de um equivalente de zinco no ácido diluído".
Em primeiro lugar, quando o processo se desenvolve puro não é posto em liberdade nenhum calor, na cadeia; visto como a energia que vai sendo posta em liberdade é transformada em eletricidade, e, somente devido à resistência do conjunto do circuito, uma parte dela é convertida em calor.
Em segundo lugar, a força viva é igual à metade do produto da massa pelo quadrado da velocidade. A frase anteriormente transcrita significaria, pois, o seguinte: a energia posta em liberdade em virtude, da dissolução de um equivalente de zinco no ácido clorídrico diluído, igual a um determinado número de calorias, é também equivalente à metade do produto da massa dos íons pelo quadrado da velocidade com que são atraídos pelos metais. Assim apresentada, a frase é, à primeira vista, inexata; a força viva que resulta da migração dos íons, está muito longe de ser equivalente à energia posta em liberdade pelo processo químico(III). Mas, se o fosse, nenhuma corrente seria possível, porque não restaria nenhuma energia livre no resto do circuito. Por esse motivo, acrescenta-se de passagem, a observação de que os íons chegam ao repouso, quer formando uma combinação, quer se pondo em liberdade". Mas se a perda de energia deve abranger também as transformações de energia que se realizam nos dois processos, então ficamos definitivamente atolados. Porque ambos esses processos são exatamente aqueles aos quais devemos toda a energia que se vai pondo em liberdade; de sorte que não se pode absolutamente falar em perda, mas sim em aquisição.
É, portanto, evidente que Wiedemann, naquela sua frase, não pensou em nada de concreto e que a perda de energia significa apenas o deus ex machina que lhe possibilite o salto mortal que o transfira da velha , teoria do contato à explicação da corrente por efeito químico. Efetivamente, a perda de energia realizou aquilo de que fora encarregada, e agora está despedida; daqui por diante, o processo químico, na cadeia, passa a ser considerado como única fonte energética de produção da corrente; e o único recurso que resta ao nosso autor é procurar um meio de livrar-se, com bons modos, do que ainda resta da tentativa de produzir eletricidade por meio do contato de corpos quimicamente indiferentes, ou seja, por intermédio da pretendida força de separação elétrica que atua no local de contato entre ambos os metais.
Quando se lê a explicação de Wiedemann a respeito da corrente elétrica, anteriormente transcrita, chega-se a acreditar que temos diante dos olhos um trecho dessa apologética com que os teólogos crentes e semicrentes enfrentavam, há cerca de quarenta anos, a crítica fisiológico-histórica da Bíblia, levada a efeito por Strauss, Wilke, Bruno Bauer e outros. O método é exatamente o mesmo. É forçoso que seja. Porque, em ambos os casos, trata-se de salvar a tradição em face da ciência pensante. O empirismo exclusivo que só permite que se pense, quando muito, sob a forma do cálculo matemático imagina estar manipulando fatos inegáveis. Na realidade, porém, manipula preferentemente idéias recebidas de outrem, produtos do pensamento de seus predecessores, na sua maioria superados, tal como eletricidade positiva e negativa, força de separação elétrica e teoria do contato. Isso lhe serve para intermináveis cálculos matemáticos, por meio dos quais se torna possível esquecer, na severidade das fórmulas matemáticas, a natureza hipotética dos pontos de partida. O quanto tem de cética essa classe de empirismo, em face dos resultados do pensamento contemporâneo, possui também de crédula em face do pensamento de seus predecessores. Até mesmo os fatos experimentalmente demonstrados, para ele são considerados inseparáveis, em geral, das correspondentes elucubrações tradicionais. O fenômeno elétrico mais simples é falsificado ao ser explicado, por exemplo, por meio do contrabando das eletricidades. Essa classe de empirismo já não pode descrever corretamente os fatos, porque a interpretação tradicional está oculta por baixo dessa mesma descrição. Numa palavra: nos defrontamos, no domínio da teoria da eletricidade, com a tradição desenvolvida à semelhança do que se passa com a teologia; e, como em ambos domínios, os resultados das novas investigações (a determinação de fatos desconhecidos ou discutidos e as conclusões teóricas que deles são necessariamente deduzidas), golpeiam inexoravelmente a face das velhas tradições, ficando os defensores das mesmas num beco sem saída. Devem refugiar-se em toda a espécie de escapatórias, recorrer a tergiversações insustentáveis e à dissimulação de contradições irredutíveis e, dessa forma, acabam enredados, eles próprios, em contradições para as quais não há nenhuma solução. É essa crença na velha teoria sobre a eletricidade o que arrasta Wiedemann para uma insanável contradição consigo mesmo, já que se apega à desesperada tentativa de conciliar racionalmente a velha explicação da corrente por meio da força de contato, com a nova concepção baseada na energia química posta em liberdade.
Objetar-se-á, talvez, que a crítica anterior à explicação de Wiedemann sobre a produção de corrente baseia-se em malabarismos verbais; que, embora Wiedemann se manifeste a princípio um tanto negligente e inexato, chega por fim a uma exposição correta do fenômeno, concordante com a lei da conservação da energia; e que, assim sendo, fica reabilitado. A esse respeito, damos em seguida outro exemplo: a descrição que faz ele do processo que se realiza na cadeia zinco, ácido sulfúrico diluído, cobre.
"Se unirmos ambas as chapas por meio de um fio, então é gerada uma corrente galvânica... Através do processo eletrolítico, desprende-se da água do ácido sulfúrico diluído, do lado do cobre, um equivalente de hidrogênio que se escapa em borbulhas; e do lado do zinco, forma-se um equivalente de oxigênio, que oxida o zinco, constituindo o óxido de zinco, que se dissolve no ácido circundante sob a forma de sulfato de zinco" (I, págs. 592/593).
Para que haja desprendimento de hidrogênio e de oxigênio da água, é necessária, para cada molécula de água, uma energia equivalente a 68.924 calorias. E, donde provém, na citada cadeia, essa energia? "Do processo eletrolítico". E onde vai buscá-la o processo eletrolítico? Não há resposta à pergunta.
No entanto, Wiedemann nos diz, e não uma vez, mas duas (I, págs. 472 e 614), que "segundo novos experiências, a própria água não é decomposta" e sim, em nosso caso, apenas o ácido sulfúrico (H2 SO4) que se decompõe, por um lado em H2 e, pelo outro, SO3 + O, perdendo, em determinadas circunstâncias, H2 e O que escapam em estado gasoso. Mas, em vista disso, modifica-se inteiramente a natureza do processo (H2) do H2 SO4 é diretamente substituído pelo zinco (que é bivalente), formando sulfato de zinco (Zn SO4). Ficam livres, por um lado H2 e, pelo outro, SO3 + O. Ambos os gases se desprendem nas mesmas proporções em que formam água; o SO3 se combina com a água da solução H2 O, voltando a formar H2 SO4, isto é, ácido sulfúrico. Mas, quando se forma Zn SO4, desenvolve-se uma quantidade de energia suficiente, não só para desalojar e pôr em liberdade o hidrogênio do ácido sulfúrico, mas também para deixar um considerável excedente que, em nosso caso, é utilizado para a formação de corrente. O zinco não espera, pois, até que o processo eletrolítico ponha a sua disposição oxigênio livre, para, primeiro oxidar-se e, depois, dissolver-se no ácido. Dá-se exatamente o contrário: entra diretamente no processo, que só consegue realizar-se devido a essa intervenção do zinco.
Vemos, assim, como concepções químicas antiquadas acodem em ajuda das antiquadas concepções a respeito do contato. De acordo com as teorias mais modernas, o ácido é um sal em que o hidrogênio substitui um metal. O processo aqui examinado confirma essa noção: o deslocamento direto do hidrogênio pelo zinco explica o desenvolvimento de energia. A velha concepção, adotada por Wiedemann, considera um sal como sendo a combinação de um óxido metálica com um ácido; e, por essa razão, fala ele em óxido de zinco sulfoácido, em vez de sulfato de zinco. Mas, a fim de chegar, em nossa cadeia de zinco e ácido sulfúrico, a esse óxido de zinco sulfoácido, o zinco deve ser, primeiramente, oxidado. Para que seja possível oxidar o zinco com suficiente rapidez, é necessário haver oxigênio livre. Para se conseguir oxigênio livre, temos que supor — uma vez que aparece hidrogênio do lado do cobre — que a água seja decomposta. E para decompormos a água, se torna necessária uma enorme quantidade de energia. Como conseguí-la? Simplesmente "pelo processo eletrolítico” que, por sua vez, não pode ser posto em movimento enquanto seu produto químico final, o "óxido de zinco sulfoácido", não tenha começado a se formar. Vemos, assim, que a criança deve dar à luz a sua mãe.
De sorte que, também neste caso, todo o processo é completamente invertido por Wiedemann e posto de pernas para cima. Tudo isso porque Wiedemann mistura, sem mais nem menos, a eletrólise ativa e a passiva, dois processos inteiramente opostos, delas fazendo uma só eletrólise pura e simples.
Até agora examinamos apenas o que acontece na cadeia, isto é, aquele processo em que, devido à ação química, é posto em liberdade um excedente de energia, sendo este convertido em eletricidade por intermédio dos dispositivos da cadeia. Mas esse processo pode ser invertido: a eletricidade da corrente contínua obtida, na cadeia, em virtude da energia química, pode, por sua vez, ser reconvertida em energia química, através da célula de decomposição intercalada no circuito. Ambos os processos são evidentemente opostos: se concebermos o primeiro como químico-elétrico, o segundo será eletroquímico. Ambos podem desenvolver-se no mesmo circuito e nos mesmos corpos. Assim é que uma pilha de elementos gasosos, cuja corrente resulta da combinação de hidrogênio e de oxigênio na água, pode fornecer, por meio de uma célula de decomposição intercalada, hidrogênio e oxigênio nas mesmas proporções em que entram na formação da água. A maneira corrente de encarar esses fenómenos, confunde esses processos em uma só expressão: eletrólise, não distinguindo sequer a eletrólise ativa da passiva, não fazendo distinção entre um líquido excitante e um eletrólito positivo. Assim é que Wiedemann encara a eletrólise em geral, ao longo de 143 páginas, acrescentando finalmente algumas considerações sobre "eletrólise na cadeia" sendo que só merece pequena parte das dezessete páginas desse capítulo os fenómenos referentes ao que ocorre nas cadeias real. Também na seção seguinte, Teoria da Eletrólise, nem sequer é mencionado o contraste entre a cadeia e a célula de decomposição. E se, logo depois, procurássemos, no capítulo seguinte a esse — Influência da Eletrólise sobre a Resistência de Condução e sobre a Força Eletromotriz no Circuito — alguma referência às transformações de energia no circuito, sofreríamos, por certo, um amargo desengano.
Examinemos agora esse irresistível "processo eletrolítico" que pode separar H2 de O sem fornecimento visível de energia e que, nesses capítulos do livro, desempenha o mesmo papel que anteriormente exerce a misteriosa "força de separação elétrica".
"Ao lado do processo primário, puramente eletrolítico da separação dos íons, verifica-se também um grande número de processos secundários, inteiramente independentes do mesmo, puramente químicos, resultantes da ação dos íons separados pela corrente. Essa ação pode ser exercida sobre a matéria dos eletródios, sobre o corpo dissociado, nas soluções e sobre o meio dissolve" (I, pág. 481).
Voltemos à cadeia anterior: zinco e cobre, mergulhados em ácido sulfúrico diluído. Aqui encontraremos, segundo declaração do próprio Wiedemann, os íons H2 e O, provenientes da água. Em consequência, deve-se ter realizado a oxidação do zinco e a formação de Zn SO4, um processo secundário, independente do processo eletrolítico, inteiramente químico, apesar de o processo primário só ser possível em virtude deste último. Examinemos em seus detalhes a confusão que inevitavelmente se tem de produzir em virtude dessa inversão do verdadeiro processo.
Atenhamo-nos, em primeiro lugar, aos chamados processos secundários na célula de decomposição, da qual Wiedemann nos apresenta alguns exemplos (Págs. 481/482)(IV).
I) — Eletrólise de Na2 SO4, dissolvido em água. Este se "dissocia... em equivalente de SO3 + O e 1 equivalente de Na... Mas este último reage sobre a água e desprende equivalente de H, ao mesmo tempo que se forma equivalente de sódio, que se dissolve na água circundante". A fórmula é:
Na2 SO4 + 2H2 O = O + SO3 + 2Na OH + 2H
Neste exemplo, a dissociação seguinte:
Na2 SO4 = Na2 + SO3 + O
poderia ser concebida, na realidade, como o processo primário, eletroquímico, e a ulterior:
Na2 + 2H2 O + 2Na 0H + 2H
como um processo secundário, puramente químico. Mas esse processo secundário, origina-se diretamente no eletrodo em que aparece o hidrogênio posto em liberdade. A importante quantidade de energia (11.810 calorias por equivalente de Na, O e H, segundo Julius Thomsen) se converte, por isso, em eletricidade, pelo menos em sua maior parte; e apenas se transforma diretamente em calor. Mas este último pode também resultar da energia química posta em liberdade, direta ou indiretamente, na cadeia. Mas a quantidade de energia assim disponível e transformada em eletricidade tem que ser subtraída porque deve prover a corrente para que se dê a dissociação constante Na2 SO4. Se a conversão do sódio em hidróxido pareceu, no primeiro momento, um processo secundário do conjunto, a partir do segundo momento torna-se um fator essencial no processo do conjunto e deixa, portanto, de ser secundário.
Mas, na célula de dissociação, realiza-se um terceiro processo: SO3 se combina H2 O, formando SO4 H2 (ácido sulfúrico), caso não entre em combinação com o metal do eletrodo, pondo outra vez energia em liberdade. Essa combinação não se efetua diretamente no eletrodo, e a quantidade de energia posta em liberdade (21.320 calorias, J. Thomsen) se transforma assim, na própria célula, toda ou em sua maior parte, em calor, cedendo à corrente, quando muito, uma pequena parte de sua eletricidade. De maneira que o único produz na célula, nem sequer é mencionado por Wiedemann.
II) — "Se eletrolisarmos uma solução de sulfato de cobre, entre um elemento eletrodo positivo de cobre e outro negativo da platina, então, com a dissociação simultânea de ácido sulfúrico na mesma corrente, separa-se, no eletrodo de platina, 1 equivalente de cobre por cada equivalente de água dissociada; no eletrodo positivo deveria aparecer 1 equivalente de ácido sulfúrico; mas este se combina com o cobre, formando Cu SO4, que se dissolve na água da solução eletrolisada".
Devemos traduzir o processo, em linguagem química moderna, da seguinte maneira: na platina se deposita cobre; o SO4 livre que, como tal, não pode subsistir, se decompõe em SO3 + O e este último escapa; SO3 toma da água da solução H2 O e forma H2 SO4 que volta a combinar-se com o cobre do eletrodo, pondo H2 em liberdade. Temos assim, falando corretamente, três processos:
A primeira vista, o primeiro pode parecer primário e os outros secundários. Mas, se investigarmos as transformações, de energia, verificamos que o primeiro é totalmente compensado por uma parte do terceiro; a separação do cobre de SO4 se verifica devido a sua combinação com o outro eletrodo. Se prescindirmos da energia necessária para transferir o cobre de um para o outro eletrodo; e igualmente da inevitável perda de energia na cadeia (o que não pode ser determinado com exatidão, devido à conversão de uma parte em calor) verifica-se aqui o caso de que o chamado processo primário não subtrai nenhuma energia à corrente. A corrente fornece energia unicamente para que se torne possível a dissociação de H2 e O que (faz-se necessário acrescentar) é invertida e se apresenta como o resultado real de todo o processo, isto é, da realização de um processo secundário e outro terciário.
Em ambos os exemplos anteriores, como também em outros casos, a distinção entre processos primários e secundários tem, no entanto, uma certa e inegável justificação. Assim é que, nos dois casos, a água parece que se decompõe; e que os elementos componentes da água se desprendem nos eletródios opostos. Considerando que, segundo as mais recentes experiências, a água quimicamente pura se aproxima, tanto quanto possível, do ideal de um corpo não condutor (isto é, de um corpo que não pode ser eletrólito), é importante assinalar que neste e em muitos outros casos semelhantes, a água não é diretamente dissociada, durante a eletrólise, mas sim que os elementos da água são desprendidos do ácido, mesmo quando a água deve participar da formação desse ácido.
III) — "Se eletrolisarmos, ao mesmo tempo, em dois tubos... ácido clorídrico... e se usarmos zinco num dos eletródios e cobre no outro, no primeiro tubo se dissolve uma quantidade de 32,53 de zinco e, no segundo, uma de 2 X 31,7 de cobre".
Deixemos o cobre de lado, por enquanto, e cuidemos do zinco. Como processo primário, admitamos a dissociação de HCl e, como elemento to secundário, a dissolução de Zn.
Segundo essa concepção, a corrente fornece à célula de dissociação a energia necessária para a separação de H e Cl; e, depois de se haver realizado essa separação, Cl se combina com Zn, ficando em liberdade uma quantidade de energia que é subtraída da necessária para a separação de H e Cl, de maneira que a corrente precisa apenas fornecer a diferença. Até agora tudo vai muito bem; mas, se examinarmos mais de perto ambas as quantidades de energia, verificaremos que aquela posta em liberdade para a formação de Zn Cl2, é maior que a consumida para decompor 2H Cl; e que, portanto, a corrente não só está dispensada de fornecer qualquer quantidade de energia, como também, pelo contrário, recebe energia. Assim sendo, já não temos perante nós um eletrólito passivo, mas sim um líquido excitante; não temos nenhuma célula de dissociação, mas sim uma cadeia que reforça, com um elemento. a pilha formadora da corrente. O processo que devíamos considerar como secundário se nos apresenta como absolutamente primário: é ele a fonte de energia do processo de conjunto, tornando-o independente da corrente que recebe da pilha.
Vemos agora, claramente, qual a origem de toda a confusão que reina ao longo da exposição teórica de Wiedemann. É que ele parte da eletrólise; que esta seja ativa ou passiva, cadeia ou célula de dissociação pouco lhe importa; uma caixa de ataduras é uma caixa de ataduras, como dizia o major ao doutor em filosofia, que prestava o serviço militar de um ano. E, como a eletrólise, na célula de dissociação, é muito mais fácil de estudar do que na cadeia, Wiedemann toma como ponto de partida a célula de dissociação e transforma os processos que nela se realizam (de sua distinção, em parte justificada, em primários e secundários) em medida dos processos exatamente inversos que se sucedem na cadeia. E, nem sequer percebe quando a célula de decomposição se converte em cadeia. E, por esse motivo, pode formular o seguinte princípio: "A afinidade química dos corpos não dissociados pelos eletródios não exerce influência sobre o processo eletrolítico propriamente dito" (pág- 471), princípio que, como já vimos, é inteiramente falso sob essa forma absoluta. Daí provém sua tríplice teoria sobre a formação de corrente: em primeiro lugar, a da velha tradição, por meio do contato puro e simples em que, de modo inexplicável, a corrente procura em si mesma ou no processo eletrolítico" a energia necessária para separar H de Cl, na cadeia, e mais ainda para produzir a corrente; e finalmente, a moderna eletroquímica, que estabelece como fonte dessa energia a soma algébrica de todas as ações químicas que se verificam na cadeia. Como ele não percebe que a segunda explicação destrói a primeira, não suspeita também que a terceira invalida a segunda. Pelo contrário, o princípio da conservação de energia é justaposto, duma forma superficial, à velha teoria, transmitida pela rotina, como um novo princípio geométrico fica ligado aos anteriores. Nem de leve se suspeita que esse novo princípio torna imprescindível uma total revisão dos pontos de vista tradicionais, neste como em todos os domínios das ciências naturais. Por essa razão, Wiedemann limita-se apenas a tomar nota da inovação, ao explicar a formação da corrente; e, em seguida, põe a mesma de lado, tranquilamente, para voltar a aplicá-la novamente, no fim do livro, no capítulo que trata do rendimento de trabalho da corrente. Ainda no que se refere à teoria da produção de eletricidade por meio do contato, (I, pág. 781 e seg.) a conservação da energia não desempenha nenhum papel no que diz respeito ao ponto principal, sendo apenas levada em consideração com o fim de esclarecer alguns pontos secundários; para ele, trata-se, decididamente, de "um processo secundário".
Voltemos ao anterior exemplo III. Ali se eletrolisa, com a mesma corrente, ácido clorídrico em dois tubos em U, mas usando, em um, zinco e, noutro, cobre como eletródios positivos. Segundo a lei fundamental em eletrólise, estabelecida por Faraday, a mesma corrente elétrica dissocia, em cada célula, quantidades equivalentes em ambos os eletródios; e as quantidades das substâncias separadas em ambos os eletródios, estão também na mesma proporção de suas valências (I, pág. 470). Verifica-se, então, que, no primeiro tubo, se dissolveu uma quantidade de 32, 53 e, no segundo, uma de 2 X 31,7. E Wiedemann acrescenta: "Mas isso não constitui nenhuma prova da equivalência dos referidos valores. Os mesmos só se observam no caso de correntes muito pouco densas com formação de cloreto de zinco... de um lado e de cloreto de cobre... do outro lado. Com correntes mais densas, a quantidade de cobre dissolvido, para a mesma de zinco, desceria até 31,7... com formação de quantidades crescentes de cloreto".
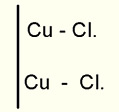
É sabido que o zinco realiza uma única combinação com o cloro: o cloreto de zinco; o cobre, entretanto, realiza duas: o cloreto cúprico (Cu Cl2) e o cloreto cuproso (Cu2 Cl2). O processo insiste, pois, em que a corrente débil (e não a "pouco densa") absorve, por cada dois átomos de cloro dos eletródios, dois de cobre, os quais se mantém unidos entre si por uma de suas valências enquanto as outras duas que ficam livres se unem a dois átomos de cloro:
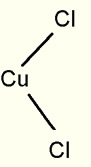
Se, entretanto a corrente se tornar mais forte, absorve os átomos de cobre inteiramente, uns dos outros; e cada um, por si, se combina com dois átomos de cloro:
Com correntes de intensidade média, são conjuntamente produzidas ambas as combinações. É, portanto, a intensidade da corrente o que determina a formação de uma ou outra combinação; e o processo, por isso, é essencialmente eletroquímico, se é que essa palavra tem algum sentido. No entanto, Wiedemann o considera secundário, isto é, não eletroquímico, mas sim exclusivamente químico.
A experiência citada é de Renault (1867) e pertence a uma série de experiências semelhantes, nas quais a mesma corrente foi conduzida. por um tubo em U, através de uma solução de sal comum (eletrodo positivo, zinco); e, noutra célula através de eletródios variados, tendo diferentes metais como eletródios positivos. As quantidades dissolvidas de outros metais, relativamente a um equivalente de zinco, diferem muito entre si; e Wiedemann dá os resultados de toda a série, mas os que são realmente químicos se tornam evidentes, não podendo sê-lo de outra maneira. Assim, se dissolveu em ácido clorídrico, por um equivalente de zinco, apenas 2/3 de equivalente de ouro. Isso não é surpreendente senão quando nos aferramos, como Wiedemann, às velhas equivalências e aprontamos como fórmula do cloreto de zinco Zn Cl, na qual o zinco aparece, da mesma forma que o cloro, com uma única valência. A verdade é que, a cada átomo de zinco correspondem dois de cloro; e, quando conhecemos essa fórmula, sabemos, que, com aquela maneira de representar as equivalências, devemos tomar, como unidade, o átomo de cloro e não o de zinco. Mas a fórmula do cloreto de ouro é Au Cl3: donde se torna evidente que 3 Zn C12 contêm exatamente a mesma quantidade de cloro que 2 Au Cl3. Portanto, todos os processos, tanto primários como secundários e terciários da cadeia, serão forçados a converter em cloreto de ouro apenas 2/3 de uma parte-peso(6) de ouro por cada parte-peso de zinco. Isso prevalece de maneira absoluta, a não ser que o Au Cl3 (7) pudesse também formar-se pela via galvânica; nesse caso, teriam que ser dissolvidas até duas equivalências de ouro por cada equivalência de zinco (para a formação de um cloreto áureo, com um só átomo de cloro por cada átomo de metal); e poderiam verificar-se as mesmas variações, segundo a força da corrente, que as resultantes do cloro com o cobre. O mérito das experiências de Renault consiste precisamente em que demonstram, como a lei de Faraday é confirmada por fatos que aparentemente a contradizem. Mas até que ponto podem contribuir para esclarecer os processos secundários, na eletricidade, não é possível prever.
O terceiro exemplo tomado de Wiedemann, conduzia-nos, de novo, da célula de dissociação à cadeia. Na realidade, a cadela oferece o maior interesse quando analisamos os processos eletrolíticos em relação com as transformações de energia que os acompanham. Assim nos defrontamos, não poucas vezes, com cadeias cujos processos químicos parecem efetuar-se em contradição frontal com a lei da conservação da energia e contra a afinidade química.
Segundo os cálculos de Poggendorf, a cadeia zinco — solução concentrada de sal comum -platina, produz uma corrente de intensidade, igual a 134,6. Obtemos assim uma quantidade respeitável de energia elétrica, 1/3 a mais que num elemento de Daniell. Donde procede, neste caso, a energia que se apresenta como eletricidade? O processo primário é o deslocamento do sódio pelo zinco, segundo a combinação clássica. Mas, na química corrente, o zinco não desloca o sódio; mas sim, inversamente, o sódio é que desaloja o zinco em suas combinações, quer sejam clóricas ou outras. O processo primário, longe de poder dar à corrente a citada quantidade de energia, necessita, pelo contrário, para produzir-se, um suprimento de energia vindo da parte externa. De modo que, apenas com o processo primário, voltamos à estaca zero. Examinemos melhor em que consiste o verdadeiro processo. Verificaremos então que a combinação não é:
Zn + 2 Na Cl + 2H2 O = Zn CI + 2Na
mas, sim
Zn + 2Na Cl + 2H2 O = Zn Cl2 + 2Na OH + H2
Em outras palavras: o sódio não se desprende em liberdade, no eletrodo negativo, mas sim hidroxidado, como no exemplo anterior (I, págs. 571-737).
Para calcular as produções de energia obtidas, os estudos de Thomsen nos fornecem, pelo menos, alguns pontos de referência. Segundo ele, temos energia posta em liberdade, conforme as seguintes combinações:
| (Zn Cl2) = 97.210; (ZnCl2, água) 15.630, num total para o cloreto de zinco dissolvido = 112.840 calorias |
| 2 (Na, O, H, água).............................................................................................= 223.620 calorias |
| Total ...............................................................................................................= 336.460 calorias |
A deduzir desse total, devido ao consumo nas dissociações:
| 2 (Na, O, H, água) = 193.020 calorias |
| 2 (H2, 0) .............= 136.740 calorias |
| Total ..................= 329.740 calorias |
Excedente de energia em liberdade = 6.720 calorias.
Essa quantidade é evidentemente pequena em relação à força da corrente, mas é suficiente para esclarecer, por um lado, a dissociação do sódio e do cloro e, por outro, a formação da corrente.
Temos aí um exemplo convincente de que a distinção que se pretende fazer entre processos primários e secundários é inteiramente relativa, podendo levar-nos ao absurdo, caso a consideremos como absoluta. O processo eletrolítico primário, além de não poder dar origem a corrente de espécie alguma, nem sequer é capaz de realizar-se por si mesmo. O processo secundário, considerado como puramente químico, é exatamente aquele que torna possível a realização do primeiro e, além disso, fornece todo o excedente de energia necessária à formação da corrente. Fica assim demonstrado ser ele, na realidade, o primário; e fica provado ser este o secundário. Quando Hegel, por meio do raciocínio dialético, convertia no contrário as concepções e leis imaginárias dos metafísicos e dos naturalistas metafisicantes, dizia-se que ele lhes havia revirado as palavras dentro da boca. Mas quando a Natureza procede da mesma forma que o velho Hegel, parece que já é tempo, na verdade, de examinar a coisa mais de perto.
Com maior fundamento ainda, podem ser considerados como secundários os processos que desenrolam em consequência do processo químico-elétrico da cadeia (mas independentes e isolados deles) e que se efetuam a certa distância dos eletródios. As transformações de energia que se verificam nessa espécie de processos secundários não intervêm, em consequência, no processo elétrico: não subtraem, nem fornecem energia. Essa classe de processos se verificam frequentemente na célula de dissociação; mais acima podemos encontrar um, no exemplo I, onde se verifica a formação de ácido sulfúrico, durante a eletrólise do sulfato de sódio. Nesse caso, porém, eles não merecem maior atenção. Pelo contrário, na cadeia, o seu apartamento é de maior importância prática. Por isso que, mesmo quando não subtraem ou não fornecem diretamente energia ao processo químico-elétrico, alteram, entretanto, a soma total de energia disponível na cadeia, afetando-a, assim, diretamente.
A esse grupo pertencem (além das transformações químicas residuais, ordinárias) os fenómenos que se manifestam quando os íons que se desprendem dos eletródios adquirem outro estado que não aquele sob o qual se apresentam comumente neles, sendo que só passam a esse novo estado depois de se haverem afastado dos eletródios. Os íons podem, então, adquirir outra densidade e outra forma de agregação. Mas, podem, também, sofrer transformações importantes no que se refere a sua constituição molecular, sendo esse caso o mais interessante. Em todos esses casos, às modificações químicas ou físicas verificadas nos íons (as quais se produzem a uma certa distância dos eletródios), corresponde uma semelhante mudança de temperatura: quase sempre é posto calor em liberdade, mas às vezes é ele absorvido. Essa mudança de temperatura se limita, por certo, no princípio, ao local em que se produz: o líquido da cadeia ou a célula de dissociação se aquece ou esfria, ao passo que o resto do circuito conserva a mesma temperatura. Por isso, esse calor é denominado calor local. A energia química posta em liberdade e disponível para ser convertida em eletricidade, aumenta ou diminui na mesma proporção desse calor local, positivo ou negativo. Em uma cadeia constituída de água oxigenada e ácido clorídrico, 2/3 de toda a energia posta em liberdade foram consumidos sob a forma de calor; o elemento de Grove, pelo contrário, esfriava-se notadamente e trazia assim, ao circuito de corrente, energia de fora devido a essa absorção de calor. Verifica-se, portanto, que também esses processos secundários repercutem sobre os primários. Podemos colocar-nos na posição que quisermos: a distinção entre processos primários e secundários é sempre relativa e, por meio da interação de ambos, volta a ser continuamente abandonada. Se não levarmos isso em conta, se encararmos essas oposições relativas como sendo absolutas, somos irremediavelmente enredados em contradições, tal como vimos.
Na separação eletrolítica de gases, os eletródios metálicos cobrem-se de uma delgada camada gasosa; em consequência disso, a intensidade da corrente diminui até que o eletrodo fique saturado de gás (o quanto lhe é possível reter por adesão), depois do que a corrente debilitada se mantém constante. Favre e Silbermann demonstraram que, numa célula de decomposição dessa espécie, também se produz calor, o que só pode acontecer devido a que os gases, nos eletródios, não são postos em liberdade no estado sob o qual se apresentam comumente, mas passam a esse estado comum somente depois de se desprenderem dos eletródios; e isso, através de um processo em que há, ao mesmo tempo, desprendimento de calor. Mas, em que estado são esses gases postos em liberdade no eletrodo? Não é possível manifestar-se, a esse respeito, mais prudentemente do que o faz Wiedemann, denominando-o "certo estado", "alotrópico" e, finalmente, quanto ao oxigênio "ozonizado". Quando se refere ao hidrogênio, fala mais misteriosamente. Em certos trechos, deixa transparecer a idéia de que o ozônio e o peróxido de hidrogênio são as formas sob as quais se manifesta esse estado "ativo". O ozônio persegue de tal maneira o nosso autor, que ele chega ao ponto de procurar explicar as propriedades extremamente eletronegativas de certos peróxidos, dizendo que "possivelmente eles contêm uma parte de oxigênio em estado ozonizado!" (I, pág. 57). Seguramente, durante a chamada substituição da água, formam-se tanto ozônio como o peróxido de hidrogênio, mas só em pequenas quantidades. Carece de todo fundamento a suposição de que o calor local pode proceder, no caso anterior, do aparecimento e, logo depois, da decomposição de grandes quantidades dessas combinações. Não conhecemos o calor de formação do ozônio, que é constituído pela união entre si de três átomos de oxigênio O3 (ao invés de dois que constituem o oxigênio comum). O do peróxido H2 O (em estado líquido) + O é, segundo Bertelot, igual a — 21.480. O aparecimento dessa combinação em grandes quantidades, condicionaria, pois, um forte suprimento de energia (mais ou menos 30% da necessária para a dissociação de H2 O) que teria de ser notável e verificável. Finalmente, o ozônio e o peróxido de hidrogênio absorveriam apenas o oxigênio (desde que prescindíssemos das inversões de corrente nas quais ambos os gases se juntariam no mesmo eletrodo), mas não absorveriam o hidrogênio. E, no entanto, este também se desprende sob um estado "ativo": no dispositivo munido de uma solução de nitrato de potássio, entre dois eletródios de platina, combina-se diretamente com o nitrogênio desprendido, formando amoníaco.
Todas essas dificuldades e causas de cavilações não existem na realidade. Desprender corpos "em estado ativo" não constitui monopólio do processo eletrolítico. Qualquer decomposição química produz o mesmo resultado. Ela separa, primeiro, o elemento posto em liberdade sob a forma de átomos livres O, H, N etc., que, só depois de sua libertação, podem combinar-se em moléculas O2, H2, N2; e, ao se combinarem dessa forma, cedem uma certa quantidade de energia, até agora não determinada(8), que se manifesta sob a forma de calor. Mas durante o instante infinitesimal em que os átomos ficam livres, são portadores de toda a energia que podem conter em si; e, na posse de sua energia máxima, possuem a faculdade de entrar em qualquer combinação que lhes seja oferecida. Encontram-se, assim, "em um estado ativo", relativamente às moléculas de O2, H2, N2. Estas já terão cedido uma parte de sua energia e não poderão entrar em combinação, sem que essa quantidade de energia cedida lhes seja fornecida de fora para dentro. Não é, pois, de maneira nenhuma, necessário refugiar-nos no ozônio ou no peróxido de hidrogênio, já que eles também são produtos desse estado ativo. Podemos, por exemplo, realizar, por simples via química, sem cadeia, a já citada formação de amoníaco (na eletrólise com nitrato de potássio), se juntamos ácido nítrico, na solução de um nitrato, a um líquido em que o hidrogênio seja posto em liberdade por qualquer processo químico. O estado ativo do hidrogênio é o mesmo em ambos os casos. O interessante no processo eletrolítico é que, nele, a brevíssima existência dos átomos livres se torna, por assim dizer, quase palpável. O processo se divide, neste caso, em duas fases: a eletrólise entrega os átomos livres aos eletródios; mas a sua combinação em moléculas se realiza a certa distância dos mesmos. Por ínfima e imperceptível que seja mas distância relativamente as relações de massa, ela é suficiente para impedir, pelo menos em sua maior parte, a utilização da energia, posta em liberdade ao se formarem as moléculas para a produção de eletricidade, e conseguir assim sua transformação em calor: o calor local da cadeia. Dessa maneira fica demonstrado que os elementos se desprenderam na qualidade de átomos livres e, por um momento, existiram como átomos livres na cadeia. Este fato, que não podermos determinar, na química pura, senão por meio de conclusões teóricas(9), nos é demonstrado agora experimentalmente, na medida em que isso é possível sem percepção sensorial dos próprios átomos e moléculas; e nisso consiste o alto significado científico do chamado calor local na cadeia.
A transformação da energia química em eletricidade, por intermédio da cadeia, é um processo sobre cujo desenvolvimento quase nada, sabemos; e provavelmente, só chegaremos a saber alguma coisa mais quando for melhor conhecido o modus operandi do próprio movimento elétrico.
Atribui-se à cadeia uma "força de separação elétrica" H que, em cada cadeia, possui um grau determinado. Como já vimos, no princípio, Wiedemann admite que essa força de separação não é uma forma de energia. Pelo contrário, em princípio, não é mais do que a capacidade, a propriedade da cadeia, de converter em eletricidade determinada quantidade de energia, na unidade de tempo. Essa energia química, por sua vez, não toma nunca a forma de "força de separação elétrica", durante todo o desenvolvimento do processo; pelo contrário, imediata e diretamente, se apresenta sob a forma do que se denomina "força eletromotriz", isto é, de movimento elétrico. Isso porque, quando na vida ordinária nos referimos à força de uma máquina a vapor, queremos dizer que a mesma pode converter em movimento, na unidade de tempo, determinada quantidade de calor; mas isso não nos autoriza a introduzir, na ciência, essa confusão de conceitos. Com igual fundamento, poderíamos nos referir à força de uma pistola, de uma carabina ou de um fuzil porque, com a mesma carga de pólvora, alcançam diferentes distâncias. Nesse caso, salta claramente à vista o absurdo da designação. Toda gente sabe que é a explosão da carga de pólvora que impulsiona o projétil; e que a diferença de alcance da arma depende apenas do maior ou menor desperdício de energia, de acordo com o comprimento do cano, a liberdade de movimento do projétil dentro do cano e a forma do referido projétil. Pois o caso é o mesmo no que se refere à força do vapor e à força de separação elétrica. Duas máquinas a vapor (em igualdade de condições, isto é, admitindo-se que seja igual, em ambas, a energia posta em liberdade, num tempo igual), ou duas cadeiras galvânicas, nas mesmas condições, se distinguem, quanto a seu rendimento de trabalho, apenas pelo maior ou menor desperdício de energia que nelas se verifica. E, se a técnica das armas de fogo de todos os exércitos pode desenvolver-se sem levar em conta determinada força de tiro dos fuzis, a ciência da eletricidade não tem razão alguma para fazer a suposição de uma "força de separação elétrica", semelhante a essa força de tiro, força essa que não possui absolutamente nenhuma energia e que, portanto, não pode realizar, por si só, nem um milionésimo de miligrama-milímetro.
O mesmo se pode dizer em relação à segunda forma dessa "força de separação", isto é, à "força de contato" dos metais, mencionada por Helmholtz. Não é ela outra coisa que não a propriedade que possuem os metais de converterem em eletricidade, pelo contato entre si, a energia disponível sob outra forma qualquer. Ela é também uma força que não contém sequer uma parcela de energia. Se admitirmos, com Wiedemann, que a fonte de energia, na eletricidade de contato, reside na força viva do movimento de adesão, então essa energia existe, primeiramente, sob a forma desse movimento de massa; e, quando este desaparece, converte-se imediatamente em eletricidade, sem apresentar, por um momento sequer, a forma de "força de separação elétrica" que, não só não contém qualquer energia, como também, pelo seu próprio conceito, não a pode conter de maneira alguma! Essa proporcionalidade entre energia e não-energia pertence, evidentemente à mesma matemática em que figura a "relação entre a eletricidade e o miligrama". Mas, por detrás dessa idéia absurda (cuja existência é apenas devida à concepção segundo a qual uma simples propriedade é apresentada como uma força), esconde-se uma tautologia muito simples: a capacidade que tem determinada cadeia de transformar em eletricidade a energia química posta em liberdade, mede-se... por que meio? Exatamente assim: pela quantidade de energia que reaparece no circuito, sob a forma de eletricidade, em relação com a energia química consumida pela cadeia. Eis aí.
Para poder chegar a uma força de separação elétrica, é necessário levar a sério o recurso de emergência relativo aos fluídos elétricos. Para que estes sejam transferidos de sua neutralidade para a sua popularidade, para arrancá-los, assim, um do outro, é necessário um certo gasto de energia:... a força de separação. Uma vez separadas entre si, ambas as eletricidades podem ceder a mesma quantidade de energia, ou se unirem: a força eletromotriz. Mas, como hoje em dia, ninguém considera, nem mesmo Wiedemann, as duas eletricidades como entes reais, seria, dissertar para um público já morto, se examinássemos mais detalhadamente semelhantes noções.
O erro fundamental da teoria do contato consiste em não poder ser separada da idéia segundo a qual a força de contato ou a de separação elétrica é uma fonte de energia, separação que se torna dificílima quando transformamos em uma força a simples propriedade que como uma força deve ser exatamente uma forma definida de energia; possui um aparelho de transmitir um a transformação de energia; visto como Wiedemann não consegue libertar-se dessa concepção obscura (apesar de que, ao lado dela, lhe tenham sido impostas as modernas noções a respeito da energia indestrutível e increável), é por isso levado à explicação n. 1 da corrente, a qual não tem sentido, e a todas as demais contradições que assinalamos.
Se a expressão "força de separação elétrica" constitui claramente um contra-senso, a outra, a denominada "força eletromotriz", é, pelo menos, supérflua. Tivemos motores térmicos muito tempo antes de que tivéssemos motores elétricos e, no entanto, a teoria do calor se arranja muito bem sem ter necessidade de uma força termo-motriz especial. Assim como o simples termo calor abrange todos os fenómenos do movimento pertencentes a essa forma de energia, o mesmo acontece com o termo eletricidade, no seu domínio especifico. Além do mais, muitos dos efeitos da eletricidade não são, de forma alguma, “motores”: a imantação do ferro, a decomposição química, a transformação em calor. E, finalmente, em toda a ciência natural, até mesmo na mecânica, constitui um progresso sempre que alguém consegue, de alguma forma, libertar-se da palavra força(10).
Vimos que Wiedemann não admitia, sem uma certa resistência a explicação, por meios químicos, da produção de corrente na cadeia. Essa resistência o persegue constantemente em tudo quanto se refere à teoria química, isso acontece inevitavelmente. Assim, diz ele
"não está demonstrado, de maneira alguma, que a força eletromotriz seja proporcional à ação química" (I, pág-791).
É certo que não o está em todos os casos; mas, quando essa proporcionalidade não se realiza, isso prova somente que a cadeia está mal construída, que se verificam nela desperdícios de energia. Por isso mesmo, Wiedemann tem muita razão, quando, em suas deduções teóricas sobre as circunstâncias acessórias de caráter (as quais falseiam a pureza do processo), não as leva em consideração de forma alguma, e sim assegura, sem qualquer subterfúgio, que a força eletromotriz de um elemento é igual ao equivalente mecânico da ação química que nele se verifica, pela unidade de intensidade da corrente.
Noutra passagem diz ele:
“Que, na série ácido-álcali, a combinação do ácido e do álcali não constitui a causa da produção da corrente, é a conclusão a que chegamos em virtude das experiências do § 61 (de Becquerel e Fechner), do § 260 (de Dubois-Reymond) e do § 261 (Worm-Muller), segundo os quais, em certos casos, quando aqueles se encontram em quantidades equivalentes, não se produz corrente alguma; e o mesmo se pode dizer das experiências expostas no § 62 (Henrici), segundo as quais, a força eletromotriz é também produzida quando intercalamos uma solução de salitre entre uma lixívia de potassa e ácido nítrico” (I, pág. 791).
A pergunta sobre se a combinação do ácido com o álcali constitui a causa da formação de corrente, preocupa seriamente o nosso autor. A pergunta, sob essa forma, é muito fácil de responder. A combinação do ácido e do álcali é, em primeiro lugar, a causa da formação de um sal, com desprendimento de energia. Se essa energia pode assumir, totalmente ou em parte, a forma de eletricidade, vai depender das circunstâncias sob as quais é posta em liberdade. Por exemplo: na série ácido nítrico e solução de potassa cáustica, entre eletródios de platina (este será o caso, pelo menos em parte), e indiferente, para a formação de corrente, que se intercale ou não uma solução de salitre; porque isso poderá, quando muito, retardar a formação do sal, mas não impedi-la. Mas, se fizermos uma cadeia, como a de Worm-Muller, na qual o ácido e o álcali se encontram no meio (tendo em ambos os extremos uma solução de sal, na mesma concentração que a solução a formar-se na cadeia), não será possível certamente originar-se corrente alguma; isso porque, por causa dos segmentos terminais (já que em todas as partes se formam os mesmos corpos), não é possível produzirem-se íons. Dessa forma, foi impedida a conversão, em eletricidade, da energia posta em liberdade tão diretamente como se o circuito não fosse fechado. Deixa de ser surpreendente, portanto, o fato de que este não receba corrente alguma. Mas o fato de que um ácido e um álcali podem gerar eletricidade é demonstrado pela cadeia de carvão, ácido sulfúrico (1 em 10 de água), potassa cáustica (1 em 10 de água), carvão — a qual, segundo Roault, produz uma corrente de intensidade igual a 73(V); e que, por meio de uma disposição adequada da cadeia, podem provocar, por sua combinação, uma intensidade de corrente correlativa à quantidade de energia por ela posta em liberdade, isso pode ser deduzido do fato de que as mais fortes cadeias conhecidas até agora baseiam-se quase exclusivamente na formação de sais alcalinos. Tomemos alguns exemplos de Wheaststone: cadeia da platina, cloreto de platina, amálgama de zinco em vez de potássio, a corrente diminuía duma quantidade, quase igual a 100. Beetz, com uma cadeia de magnésio, solução de permanganato, lixívia de potassa, potássio metálico, obteve uma corrente de intensidade = 298,8. Joule, com platina, ácido nítrico, lixívia de potassa, amálgama de potássio, uma corrente de 302. A "causa" da geração dessas correntes excepcionalmente fortes — ele o reconhece -, é a combinação de ácido e álcali (ou o metal alcalino), e a grande quantidade de energia por ela posta em liberdade.
Algumas páginas adiante, volta ele a dizer:
“Mas é preciso levar-se em conta que a equivalência, em trabalho, de toda a ação química que se verifica no local de contato dos corpos heterogêneos, não pode ser considerada como medida direta da força eletromotriz, num circuito fechado. Quando, por exemplo, na cadeia ácido-álcali, de Becquerel (eis aqui, Crispin!) se combinam essas duas substâncias; quando, na cadeia — platina, salitre fundido, carvão -, o carvão se queima; quando, em um elemento comum, cobre, zinco impuro, ácido sulfúrico diluído, o zinco se dissolve rapidamente, com formação de correntes locais, então, uma grande parte do trabalho produzido (ou melhor, de energia posta em liberdade) nesses processos químicos... se converte em calor e, assim, é perdida para o conjunto do circuito" (II, pág-798).
Todos esses processos nos reconduzem à perda de energia, na cadeia; em nada influi sobre o fato de que o movimento elétrico proceda de energia química que mudou de forma, mas sim sobre a quantidade de energia convertida.
Os técnicos em assuntos de eletricidade dedicaram um tempo e um labor imensos para compor as mais variadas cadeias e medir sua "força eletromotriz". O material experimental assim acumulado contém muita coisa valiosa, mas também grande soma de coisas sem valor. Que valor tem, por exemplo, as experiências em que se usa água como eletrólito, quando, conforme demonstrou agora Kohlrausch, ela é o pior condutor, isto é, o pior eletrólito(VI), razão pela qual, não é a água mas as suas conhecidas impurezas que determinam o processo? E, no entanto, quase a metade das experiências de Fechner, por exemplo, se baseiam em semelhante emprego da água, até o seu experimentum crucis, por meio do qual pretendia basear inamovivelmente a teoria do contato, erguendo-a sobre os escombros da teoria química. Como se pode concluir de tudo isso, em quase todas as experiências, com exceção de algumas, os processos químicos realizados na cadeia (apesar de serem a fonte dos processos denominados "eletromotores") só foram levados em conta com certa relutância. Mas há também toda uma série de cadeias, cuja composição química não nos autoriza a tirar nenhuma conclusão segura sobre as transformações químicas que nelas se produzem depois de fechado o circuito. Pelo contrário, como diz Wiedemann (I, pág. 797), "não se pode negar que ainda não é possível, de maneira alguma, passar por alto no que se refere às atrações químicas na cadeia". Todas essas experiências carecem, portanto, de valor, sob o ponto de vista químico, cada vez mais importante, enquanto não forem repetidos e controlados esses processos.
Nessas experiências, só muito excepcionalmente são levadas em consideração as transformações de energia verificadas na cadeia. Muitas delas foram realizadas antes de ter sido reconhecida, nas ciências naturais, a lei da equivalência do movimento; e continuam passando de um manual a outro, segundo o costume, sem terem sido controladas, nem terminadas. Quando se disse que a eletricidade não possui inércia (o que tem tanto sentido como dizer-se que a velocidade não tem peso específico), de modo algum se pode sustentar o mesmo ponto de vista a respeito da teoria da eletricidade.
Consideramos, até agora, o elemento galvânico como um dispositivo em que, por consequência das relações de contato, a energia química é posta em liberdade e transformada em eletricidade, de uma forma até agora desconhecida. Apresentamos também a célula de dissociação como sendo um aparelho em que se produz o processo inverso: o movimento elétrico é convertido em energia química e consumido como tal. Por esse motivo, devemos destacar, em primeiro lugar, o aspecto químico do processo, tão descuidado pelos técnicos em eletricidade, por ser esse o único caminho para nos livrarmos da confusa mistura de noções tradicionais, derivadas da velha teoria do contato e dos fluídos elétricos. Uma vez resolvido isso, é necessário verificar se o processo químico, na cadeia, se desenvolve nas mesmas circunstâncias que fora dela; ou se, no mesmo, se apresentam fenómenos especiais, dependentes da excitação elétrica.
As noções inexatas são, em todas as ciências, afinal de contas (se pusermos à margem os erros de observação), noções inexatas baseadas em fatos exatos. Os fatos permanecem, mesmo quando verificamos a inexatidão das primeiras. Muito embora tenhamos sacudido fora a velha teoria do contato (como um cão sacode a água ou o pó que o incomodam), persistem no entanto os fatos verificados, esses mesmos a que essa teoria seria serve de explicação. Consideramos, então, os fatos e, por meio deles, o lado propriamente elétrico do processo que se realiza na cadeia.
Ninguém contesta o fato de que, no contato de corpos heterogêneos, com ou sem transformações químicas, se verifica uma produção de eletricidade (o que se pode verificar, conforme o caso, com o eletroscópio ou com o galvanómetro). A fonte de energia produtora desses fenómenos de movimento diminuto é difícil determinar, em cada caso isolado, como já vimos antes; mas a existência de uma dessas fontes externas é por todos admitida.
Kohlrausch publicou, em 1850/53, uma série de experiências nas quais colocou, aos pares, os diferentes componentes de uma cadeia, verificando separadamente os diferentes eletrostáticos: a força eletromotriz do elemento deve resultar da soma algébrica desses potenciais. Considerando a tensão Zn/Cu = 100, calculou a intensidade relativa do elemento de Daniell ou de Grove da maneira seguinte:
Daniell:
Zn | Cu + amálgama Zn | H2 SO4 + Cu SO4 Cu = 100 + 149 — 21 = 228
Zn | Pt + amálgama Zn H2 SO4 + Pt | HN03 = 107 + 149 + 149 = 405
o que coincide aproximadamente com a medição direta da intensidade de corrente desses elementos. Mas esses resultados não são nada seguros. O próprio Wiedemann chama a atenção para o fato de que Kohlrausch apenas apresenta o resultado final, "mas infelizmente nenhum dado numérico sobre as experiências, separadamente". Em segundo lugar, Wiedemann reconhece, por várias vezes, que todas as tentativas feitas para determinar quantitativamente as excitações elétricas (no caso de contato entre metais e, mais ainda, entre metal e líquido) são pelo menos muito inseguras devido às numerosas fontes de erro. Se, apesar de tudo isso, ele faz repetidos cálculos com as cifras de Kohlrausch, fazemos muito bem em não acompanhá-lo, tanto mais quanto podemos dispor de outro meio de determinação que não fica sujeito a essas objeções.
Segundo Wiedemann, se submergirmos num líquido ambas as chapas excitadoras de uma cadeia e se, em seguida, as unirmos em circuito com as extremidades de um galvanômetro, "o primeiro desvio de sua agulha magnética, antes que as reações químicas tenham modificado a intensidade da excitação elétrica, representa a medida da soma das forças eletromotrizes, no circuito". Cadeias de diferente poder darão, assim, diferentes desvios iniciais; e a amplitude de seus desvios é proporcional à intensidade da corrente relativa às respectivas cadeias.
Parece que temos, de novo, ante os olhos, "a força de separação elétrica", a "força de contato", que fecha o movimento independentemente de qualquer ação química. E, com efeito: assim é que a teoria do contato, em seu conjunto, interpreta o fenômeno. Na realidade, há, no fato, uma relação entre a excitação e a reação química, a qual ainda não investigamos. Para chegar a ela, começaremos por examinar um pouco mais de perto a chamada lei eletromotriz; assim fazendo, verificaremos que, também neste caso, as noções tradicionais do contato, não só deixam de apresentar qualquer explicação como ainda obstruem o caminho a seguir para a sua explicação.
Se, num elemento qualquer de dois metais e um líquido, por exemplo, zinco, ácido clorídrico diluído, cobre, colocarmos um terceiro metal, sem uni-lo, por meio de um fio, ao circuito exterior, o desvio inicial do galvanômetro será, então, exatamente o mesmo que se verificaria sem a chapa de platina. Esta não atua, por conseguinte, sobre a excitação elétrica. Mas isso não pode ser expresso tão simplesmente em linguagem eletromotora. Por meio desta, se diz:
"Em lugar da força eletromotriz de zinco e cobre, no líquido entrou agora a soma das forças eletromotoras resultantes do zinco e platina, e de platina e cobre. Como o caminho das eletricidades não foi sensivelmente modificado em virtude da intercalação da chapa de platina, podemos concluir (diante da igualdade dos dados fornecidos pelo galvanômetro, em ambos os casos) que a força eletromotriz produzida pelo zinco e pelo cobre, no líquido, é igual à do zinco e platina, mais a da platina e cobre. Isso estaria de acordo com a teoria exposta por Volta, segundo a qual se verifica a excitação elétrica entre dois metais, isoladamente considerados. O resultado, que corresponde a quaisquer líquidos ou metais, pode ser expresso dizendo-se que: os metais obedecem à lei de periodicidade de suas séries, durante a sua excitação por meio de líquidos. Designa-se também essa lei pelo nome de lei eletromotriz" (Wiedemann, I pág. 62).
Quando se diz que a platina, nesse dispositivo, não atua como excitadora de eletricidade, está-se expressando um fato pura e simplesmente. Quando se diz, entretanto, que atua como excitadora de eletricidade, mas com uma força igual em direções contrárias (de sorte que o efeito é anulado), converte-se um lato em uma hipótese, sem outro objetivo que não o de render homenagens à "força eletromotriz". Em ambos os casos a platina desempenha o papel de testa-de-ferro.
Durante o primeiro desvio (da agulha), não existe ainda nenhum circuito. Os ácidos, não tendo sido decompostos(11), não podem conduzir; eles só o podem fazer por meio dos íons. Se o terceiro metal não atua sobre o desvio, é simplesmente porque se encontra ainda isolado.
Como se comporta o terceiro metal depois de se haver estabelecido a corrente, e durante o tempo de duração da mesma?
A série de tensões, entre os metais, na maioria dos líquidos, é estabelecida pelo zinco (depois dos metais alcalinos) mais ou menos no extremo positivo e pela platina no extremo negativo, ficando o cobre entre ambos. De sorte que, se colocarmos a platina entre o cobre e o zinco, ela se torna negativa para ambos. Se a platina atuasse de alguma forma, a corrente teria que ir do cobre e do zinco para a platina, dentro do líquido, isto é, teria que ir de ambos os eletródios na direção da platina (que se encontra isolada), o que seria uma contradição irredutível. A condição fundamental para a atividade dos metais, na cadeia, consiste exatamente em que estejam unidos entre si através do circuito exterior. Um metal extranumerário, não unido à cadeia, figura como não condutor; não pode fornecer nem permitir que passem íons; e, sem íons, não conhecemos nenhum caso de condução de corrente, dentro dos eletrólitos. De sorte que não se trata apenas de um simples testa-de-ferro, mas sim de um verdadeiro obstáculo.
A mesma coisa se dará se ligarmos o zinco à platina e colocarmos o cobre no meio, sem união; nessa hipótese, o cobre, caso atuasse de alguma forma, daria origem a uma corrente passando do zinco para o cobre e a uma outra indo do cobre para a platina; teria ele de servir, assim, como uma espécie de eletrodo intermediário e desprender hidrogênio do lado dirigido para o zinco, o que também é impossível.
Se pusermos de lado esse modo de falar eletromotor, o caso se torna muito simples. Já tivemos ocasião de ver que a cadeia galvânica é um dispositivo em que é posta energia química em liberdade, sendo a mesma convertida em eletricidade. Consiste ela, geralmente, em um ou mais líquidos e em dois metais funcionando como eletródios, devendo estes serem unidos entre si por um condutor situado fora do líquido. Dessa forma, está montado o aparelho. Nenhuma outra coisa que ponhamos no líquido, seja metal, vidro, resina, ou o que for, poderá participar do processo químico-elétrico, na formação de corrente, enquanto não sejam provocadas alterações químicas no líquido; e, além do mais, poderá obstruir o processo. Qualquer que seja a capacidade de excitação elétrica de um terceiro metal submerso (relativamente ao líquido e a um ou outro dos eletródios da cadeia), esta não entrará em ação enquanto esse metal não for unido ao circuito fora do líquido.
Por conseguinte, não só é falsa a dedução da pretensa lei eletromotriz, estabelecida por Wiedemann, como também é falso o sentido por ele dado a essa lei. Não é possível falar-se de uma atividade eletromotriz do metal desligado da cadeia (que se compensaria a si mesma), porque essa atividade está privada, de antemão, da única condição sob a qual ela se pode exercer; nem se pode deduzir essa pretendida lei eletromotriz, baseando-a em um fato que está fora de seu domínio.
O velho Poggendorff publicou, em 1845, uma série de experiências por meio das quais mediu a força eletromotriz das mais variadas cadeias; ou melhor, a quantidade de eletricidade fornecida na unidade de tempo(12). Dentre as mesmas, são de especial valor as primeiras 27, em cada uma das quais foram unidos três metais, um depois do outro, o mesmo líquido excitante, em três cadeias diferentes; e estas foram observadas e comparadas no que se refere à quantidade de eletricidade produzida. Como bom teórico do contato, Poggendorff também colocou um terceiro metal na cadeia, sem uni-lo; e leve a satisfação de convencer-se de que esse terceiro elemento na partida era sempre um testa-de-ferro puro e simples. A importância dessas experiências, entretanto, não consiste nisso, mas, sobretudo, no fato de que as mesmas confirmam e definem o correto sentido da intitulada lei eletromotriz.
Detenhamo-nos na primeira série de cadeias. Nelas, o zinco, o cobre e a platina, imersos em ácido clorídrico diluído, estão unidos, dois a dois, entre si. Nesse caso, Poggendorff verificou que as quantidades de eletricidade produzidas (atribuindo o valor de 100 a um elemento Daniell) eram as seguintes.
| Zinco — Cobre = | 78,8 |
| Cobre — Platina = | 74,3 |
| Total | 153,1 |
| Zinco — Platina = | 153,7 |
De sorte que o zinco, unido diretamente à platina, fornecia quase exatamente a mesma quantidade de eletricidade que o zinco + cobre-platina. A mesma coisa se verificava em todas as outras cadeias, com quaisquer que fossem os metais e líquidos empregados. Quando se colocam cadeias de uma série de metais, no mesmo líquido, de modo tal que, segundo a série de periodicidade correspondente a esse líquido, emprega-se um após outro o segundo, o terceiro ou quarto (metal) etc., como eletrodo negativo em relação ao que o precede, a soma das quantidades de eletricidade produzidas por todas essas cadeias é sempre igual à produzida por uma cadeia direta entre os extremos de todas as séries de metais. Em consequência disso, as quantidades de eletricidade fornecidas, na sua totalidade, pelas cadeias zinco-zinco, zinco-ferro, ferro-cobre, cobre-prata, prata-platina, seriam iguais às fornecidas pela cadeia zinco-platina. Uma pilha constituída por todos os elementos dessa série seria totalmente neutralizada, em igualdade de outras circunstâncias, por um elemento zinco-platina intercalado em direção contraria à primeira corrente.
Assim concebida, a denominada lei eletromotriz adquire uma verdadeira e grande importância. Põe a descoberto uma nova face da correlação existente entre a ação química e a elétrica. Até agora, ao investigar especialmente a fonte de energia da corrente galvânica, essa fonte dos intercâmbios químicos nos era apresentada como sendo o lado ativo do processo; a eletricidade era por ela produzida e aparecia, assim, à primeira vista, como elemento passivo. Agora a situação se inverte. A excitação elétrica, provocada pela natureza dos corpos heterogêneos, postos em contato na cadeia, não pode acrescentar nem subtrair energia à ação química (como não acontece no caso da conversão em eletricidade da energia posta em liberdade). Mas ela pode, conforme a disposição da cadeia, acelerar ou retardar essa ação. Se a cadeia zinco-ácido clorídrico diluído-cobre fornece apenas, na unidade de tempo, metade da eletricidade fornecida à corrente pela cadeia zinco-ácido clorídrico-platina, isso quer dizer, em linguagem química, que a primeira cadeia produz apenas, na unidade de tempo, a metade de cloreto de zinco e de hidrogênio em relação à segunda. A ação química foi duplicada, mesmo quando as condições puramente químicas tenham sido as mesmas em ambas. A excitação elétrica se transformou em reguladora da ação química; apresenta-se agora como sendo o lado ativo e a ação química, como o passivo.
Assim se torna compreensível o fato de que toda uma série de processos, considerados antes como puramente químicos, se apresentem agora como eletroquímicos. O zinco quimicamente puro, caso seja atacado pelo ácido clorídrico diluído, sê-lo-á de maneira muito fraca; o zinco comercial comum, pelo contrário, dissolve-se rapidamente, daí resultando a formação de sal e de hidrogênio; nele há uma mistura de outros metais e carvão, distribuídos desigualmente nos diferentes pontos de sua superfície. Entre eles e o zinco, formam-se correntes locais, no meio ácido, nas quais os pontos de zinco constituem os eletródios positivos e os outros metais, os negativos, desprendendo-se destes as borbulhas de hidrogênio. Da mesma forma, é hoje considerado um fenômeno eletroquímico o fato de que o ferro, submerso em uma solução de sulfato de cobre, fique coberto de uma camada de metal, sendo esta resultante de correntes produzidas nos pontos heterogêneos da superfície do ferro.
Em virtude desse mesmo fenômeno, verifica-se também que as séries de tensão dos metais em líquidos correspondem em geral às séries em que os metais se deslocam uns aos outros de suas combinações com alógenos e com radicais ácidos. No extremo negativo, mais afastado da série de tensões, encontramos todos os metais do grupo do ouro: ouro, platina, paládio, ródio, os quais são dificilmente oxidáveis, não atacáveis, ou sendo-o apenas pelos ácidos e facilmente precipitados em seus sais por meio de outros metais. No outro extremo estão os metais alcalinos, que se comportam de maneira inteiramente oposta: são dificilmente separáveis de seus óxidos, exigindo grande consumo de energia; aparecem, na Natureza, quase unicamente sob a forma de sais e, como todos os metais, manifestam a maior afinidade pelos alógenos e os radicais ácidos. Entre ambos os anteriores, encontram-se os outros metais, em séries um tanto variáveis, mas sempre de uma forma tal que seu comportamento elétrico e químico coincidem. A posição de cada metal, na série, varia segundo os líquidos e talvez não esteja bem determinada para nenhum líquido. É até lícito duvidar-se de que haja, para cada líquido, uma série absoluta de tensão entre os metais. Dois pedaços do mesmo metal podem servir, ao mesmo tempo, de eletródios positivos e negativos, em cadeias ou em células de dissociação adequadas, de maneira que o mesmo metal pode ser, simultaneamente, positivo e negativo. Nos pares termoelétricos, que convertem a eletricidade em calor (quando as diferenças de temperatura são elevadas em ambas as soldaduras), a direção da corrente é invertida: o metal anteriormente positivo se torna negativo e vice-versa. Não existe também uma série absoluta, segundo a qual os metais se deslocam de suas combinações com determinado alógeno ou radical ácido: por meio de um suprimento de energia sob a forma de calor, podemos inverter, à vontade, uma série vigente na temperatura ordinária.
Verifica-se, assim, uma notável interação entre o elemento químico e o elétrico. A ação química que, na cadeia, fornece à eletricidade a quantidade de energia necessária para a formação da corrente, por sua vez, e em muitos casos, é posta em movimento e, em todos eles, tem a sua quantidade regulada pelas tensões elétricas originadas na cadeia. Se os processos realizados na cadeia antes nos pareciam químico-físicos, vemos gora que são também eletroquímicos. Sob o ponto de vista da formação da corrente permanente, a ação química se apresentava como primária; sob o ponto de vista da excitação da corrente, apresentava como secundária, acessória. A interação exclui tudo quanto seja absolutamente primário, assim como o absolutamente secundário; pois ela é justamente um processo bilateral que, em relação a sua natureza, pode ser considerado sob dois pontos de vista diferentes. Para ser compreendida em seu conjunto, deve ser examinada sucessivamente sob esses dois pontos de vista, antes que se possa coordenar o resultado geral. Mas, caso nos aferremos unilateralmente a um dos pontos de vista considerando-o absoluto em relação ao outro (ou se saltarmos arbitrariamente de um para o outro, conforme o exija momentaneamente o nosso raciocínio), permaneceremos encerrados na unilateralidade do pensamento metafísico; escapa-se-nos a correlação de conjunto e nos deixamos enredar numa contradição após a outra.
Já tivemos ocasião de ver que, segundo Wiedemann, o desvio inicial do galvanômetro, quando submergimos as chapas de excitação no líquido da cadeia (antes que as reações químicas tenham modificado a intensidade da excitação elétrica), "constitui a medida da soma das forças eletromotrizes no circuito".
Até agora tínhamos considerado a denominada força eletromotriz, como sendo uma forma da energia que, no caso vertente, era gerada por uma ação química em quantidade equivalente e que, no decurso do processo, se convertia em quantidades equivalentes de calor, de movimento de massas etc. Dizem-nos agora, de repente, que "a soma das forças eletromotrizes, no circuito", já existe mesmo antes que as reações químicas tenham posto em liberdade essa energia; ou, em outras palavras: que a força eletromotriz não é outra coisa senão a capacidade que tem uma determinada cadeia de pôr em liberdade, na unidade de tempo, uma quantidade determinada de energia química e transformá-la, depois, em movimento elétrico. Tal como antes a força de separação elétrica, agora a força eletromotriz se apresenta como uma força que não possui a mínima parcela de energia. Wiedemann entende, pois, como força eletromotriz duas coisas inteiramente diferentes: por um lado, a capacidade que tem a cadeia de pôr em liberdade determinada quantidade de energia química e transformá-la em movimento elétrico; por outro lado, a própria quantidade de movimento elétrico. Que ambas sejam, proporcionais, que uma delas seja medida da outra, não elimina as suas diferenças. A ação química, na cadeia, a quantidade de eletricidade produzida e o calor por ela desenvolvido no circuito (quando não é realizado outro trabalho) são mais que proporcionais: são equivalentes; mas isso em nada atenua as diferenças. A capacidade que tem uma máquina a vapor (com determinado diâmetro de cilindro e percurso de pistão) de produzir uma certa quantidade de movimento mecânico, em consequência do calor recebido, é uma coisa muito diferente desse mesmo movimento, muito embora lhe seja ele proporcional. Se um tal modo de encarar esse fenômeno era admissível numa época que, no terreno das ciências naturais, ainda não se falava no principio da conservação da energia, é evidente que, do momento em que se reconheceu como um fato essa lei fundamental, não se tem mais o direito de confundir a energia realmente viva, sob qualquer de suas formas, com a capacidade que possui um determinado aparelho para dar essa forma à energia que é posta em liberdade.
Essa incompreensão constitui o corolário natural da confusão. Estabelecida entre força e energia, isso em razão da chamada força de separação elétrica. Essas duas confusões são justamente o que permite fundir harmonicamente as três explicações da corrente, apresentadas por Wiedemann e totalmente contraditórias entre si; e nelas se basearam, em síntese, todos os extravios e enredos a respeito da pretensa força eletromotriz.
Além da peculiar interação, já examinada, que se verifica entre a eletricidade e os efeitos químicos, existe ainda uma segunda relação comum, indicando igualmente um íntimo parentesco entre essas duas formas de movimento. Ambas só podem subsistir, desaparecendo. O processo químico se realiza subitamente em relação a cada um dos grupos de átomos que dele participam. Só pode ser prolongado em virtude da presença de um novo material que, sem cessar, entre novamente nele. A mesma coisa acontece com o movimento elétrico. Logo após ter sido gerado por outra forma de movimento, em seguida se converte numa terceira forma; assim, somente uma continuada disponibilidade de energia, poderá produzir uma corrente permanente em que, a cada instante, novas quantidades de movimento adquirem a forma de eletricidade para, em seguida, voltar a perdê-la.
A compreensão dessa íntima conexão entre a ação química e a elétrica, e vice-versa, conduzirá a grandes resultados em ambos os campos de investigação(13). Ela está se generalizando a cada dia que passa. Entre os químicos, Lothar Meyer (1830-1895) e, depois dele, Kekulé (Friedrich, 1829-1896) declararam explicitamente que está-se aproximando o momento da readoção, com feições mais modernas, da teoria eletroquímica. Também os eletrólogos, conforme indicam os trabalhos mais recentes de Kohlrausch, parece terem chegado à convicção de que somente uma observação exata dos processos químicos, na cadeia e na célula de dissociação, poderá ajudar sua ciência a sair dessa ruela estreita das tradições caducas.
Na realidade, não é possível entrever outra maneira de se apoiar a eletricidade em fundamentos firmes (bem como o magnetismo e as tensões elétricas), a não ser mediante uma revisão geral, no terreno da química, de todas as experiências transmitidas pela rotina, experiências, não controladas, empreendidas dentro de um ponto de vista já superado; procedendo-se, enfim, com absoluta exatidão, ao exame e à medição das transformações da energia e deixando de lado, ao mesmo tempo, todas as noções tradicionais a respeito da eletricidade.
Notas de rodapé:
(I) No que diz respeito a dados experimentais, neste capítulo nos apoiamos, principalmente, no livro de Wiedemann Lehre vom Galvanismus und Elektromagnetismus, 2 tomos, em 3 partes, 2.ª ed., Braunsschweig, 1874. Em Nature de 15 de junho de 1882, há uma referência a esse "admirável tratado que, da maneira por que aparecerá, com um apêndice sobre eletrostática, será o maior tratado experimental que existe sobre a eletricidade". (N. de Engels) (retornar ao texto)
(1) Sabemos agora que a corrente, nos metais, deve-se a um movimento de elétrons, enquanto que nos eletrólitos, a água salgada, por exemplo, assim como nos gases, ela se movimenta por meio de moléculas de carga positiva e negativa. (N. de Haldane) (retornar ao texto)
(2) A opinião segundo a qual a energia elétrica está situada no éter foi a base das experiências que nos levaram à descoberta do rádio. Com a descoberta do elétron, pareceu ter sido a mesma negada. Mas o elétron, por sua vez, é considerado hoje em dia, por muitos físicos, como "um sistema de ondas ao invés de ser uma partícula perfeitamente definida. (N. de Haldane) (retornar ao texto)
(II) Uso o termo eletricidade no sentido de movimento elétrico, com o mesmo direito com que é usado o termo calor para expressar essa forma de movimento que afeta nossos sentidos como calor. Isso é tanto menos chocante quando é, de antemão, excluída toda possível confusão com o estado de tensão da eletricidade. (N. de Engels) (retornar ao texto)
(3) É necessário recordar, uma vez mais, que esse termo era empregado muito vagamente há uns sessenta anos; e que agora tem um significado preciso, não sendo, por certo, equivalente de nenhuma forma de energia. (N. de Haldane) (retornar ao texto)
(4) Ed., energia cinética. (N. de Haldane) (retornar ao texto)
(III) F. Kohlrausch (Wiedemans Annalen, VI, pág. 206) estabeleceu, recentemente, pelo cálculo, que são necessárias imensas forças para deslocar os íons, através do solvente água. Para que miligrama percorra a distância de 1 milímetro, é necessária uma força atrativa que, para H é = 32.500 quilos; para Cl é = 5.200 quilos e, em consequência, para Cl H é = 37.700 quilos. Mesmo que essas cifras sejam corretas, não afetam o que disse mais acima. Mas o cálculo contém certos fatores hipotéticos até agora inevitáveis no domínio da eletricidade e necessita, portanto, do controle experimental(5). Este parece ser possível. Em primeiro lugar, essas imensas forças devem reaparecer sob a forma de uma quantidade qualquer de calor, no lugar em que são consumidas, isto é, no caso anterior, na bateria. Em segundo lugar, a energia consumida por eles deve ser menor do que a fornecida pelos processos químicos da bateria e, por certo, numa quantidade determinada. Em terceiro lugar, essa diferença deve ser consumida no resto do circuito e deve ser igualmente verificável neste. Logo após a confirmação, por meio desse controle, podem prevalecer definitivamente as cifras anteriores. A demonstração por meio da célula de decomposição parece ainda mais realizável." (N. de Engels) (retornar ao texto)
(5) Na realidade, a hipótese era incorreta. Atualmente se acredita que, quando se dissolve Cl H em água, este se decompõe, quase completamente, em íons H positivos e íons Cl negativos, os quais não requerem forças imensas para impulsioná-los. Engels estava perfeitamente certo quanto ao seu ceticismo (N. de Haldane) (retornar ao texto)
(IV) Anote-se, uma vez por todas, que Wiedemann utiliza, por toda parte, as velhas equivalências, escrevendo HO, Zn Cl, etc. Em minhas fórmulas são empregados constantemente os 22 pesos atômicos moderno e significam, portanto, H O, Zn CL , etc. (N. de Engels) (retornar ao texto)
(6) Isso não está certo, tal como é dito. Provavelmente, parte-peso é um lapsus calami de Engels, em lugar de equivalente em peso ou outra expressão parecida. (N. de Haldane) (retornar ao texto)
(7) Isto também não tem sentido, tal como está dito. Presumivelmente, Engels se referia a um hipotético Cl Au. (N. de Haldane) (retornar ao texto)
(8) Essa quantidade não só foi agora determinada, mas também utilizada. Assim é que, se o hidrogênio se dividir primeiro em átomos, a chama ordinária de oxigênio-hidrogênio pode tornar-se muito mais forte. (N. de Haldane) (retornar ao texto)
(9) A partir de então, foi comprovado experimentalmente. (N. de Haldane) (retornar ao texto)
(10) Essa afirmação foi totalmente comprovada em face do progresso experimentado pela física nos últimos cinquenta anos. É interessante observar que os escritores idealistas empregaram esse desaparecimento da idéia de força como argumento para refutar o materialismo. (N. de Haldane) (retornar ao texto)
(V) Em todos os dados seguintes sobre intensidade de correntes, considera-se igual a 100 a intensidade do elemento Daniell. (N. de Engels) (retornar ao texto)
(VI) Uma coluna de água, a mais pura, obtida por Kohlrausch, com 1 milímetro de comprimento, oferecia a mesma resistência que um condutor de cobre de igual espessura e de largura aproximadamente igual à órbita da Lua. (Naumann, Allegemeine Chemie, pág- 729). (N. de Engels) (retornar ao texto)
(11) Esta afirmação está de acordo com a teoria dominante há cinquenta anos, mas é incorreta. (N. de Haldane) (retornar ao texto)
(12) Esta não é, por certo, a força eletromotriz no sentido moderno. (N. de Haldane) (retornar ao texto)
(13) Isto foi, desde logo, perfeitamente confirmado pelas investigações realizadas nos últimos cinquenta anos. A teoria da eletricidade foi revolucionada pelos estudos de Thomsen a respeito da condução elétrica através dos gases, fato que o conduziu à descoberta dos elétrons. E a química, no seu conjunto, inclusive a química das combinações, tais como as do carbono com o hidrogênio (que à primeira vista estão muito desligadas dos fenômenos elétricos), foi reformulada em termos eletrônicos. (N. de Haldane) (retornar ao texto)
| Inclusão | 05/08/2018 |